- Авторы
- Файлы
Гайнуллина Ю.И., Елисеева Е.В., Солодовников В.В., Лозинский Е.Ю.
Цель работы: Изучить типичные ошибки фармакотерапии при назначении лекарственных препаратов врачами первичного звена.
Материал и методы: в течение 2006 года ГУ ТФОМС ПК организована экспертиза качества оказываемой лекарственной помощи и рациональности назначений с привлечением внештатных экспертов. Для «унифицирования» экспертной оценки, программистом ГУ ТФОМС ПК была написана программа, позволяющая «выбирать» из базы препараты, стоимость которых превышала определенный пороговый уровень или пороговое количество назначенных препаратов за 1 месяц. В качестве экспертных карт использовались стандартные протоколы экспертиз.
Для участия в экспертизе привлекались врачи клинические фармакологи, имеющие стаж, первую или высшую врачебную категорию и/или ученую степень.
Результаты: при проведении экспертиз проанализировано 938 амбулаторных карт, в которых выявлено 1138 дефекта оформления выписки лекарственных средств.
Так, триметазидин назначался при: уремической кардиомиопатии, врожденных пороках развития сердца у детей, стенокардии III-IV функционального класса, в том числе и в комбинации с другими кардиометаболиками, что является расширением показаний к применению препарата. В одном случае респеридон назначен пациентке с диагнозом «сенильный склероз».
Другими отмеченными дефектами были: назначение лекарственных средств без дополнительных методов обследования, предусмотренных стандартом медицинской помощи, назначение лекарственных средств к заболеванию, не указанному в клиническом диагнозе, полипрагмазия, необоснованное назначение лекарственных средств.
Среди типичных ошибок фармакотерапии можно отметить.
1. Назначение лекарственного средства без записи осмотра врача в амбулаторной карте (симвастатин, триметазидин, альфакальцидол, милдронат, азитромицин, индапамид и др.).
2. Назначение лекарственного средства без указания способа приема/дозы (например, эналаприл 3 раза в сутки, тиоктацид «по схеме» и.т.д.).
3. Назначение лекарственных средств без проведения дополнительных методов обследования, предусмотренных стандартом медицинской помощи (например, назначение антибактериальных препаратов длительное время без определения чувствительности микрофлоры, назначение альфакальцидола без мониторинга кальций фосфорного обмена).
4. Отсутствие записи консультации узких специалистов, подтверждающих целесообразность выбора лекарственного препарата (нейролептики, иммуномодуляторы, альфакальцидол, селективные альфа-адреноблокаторы).
5. Назначение лекарственных средств при наличии противопоказаний.
6. Назначение лекарственных средств синонимов и аналогов по фармакотерапевтическому действию: одновременное применение НПВС в двух лекарственных формах (системно и местно), одновременно применение м-холинолитиков — атровент (ипратропия бромид)+спирива (тиотропия бромид) и др.
Указанные случаи являлись высокозатратными.
Вывод: работа врачей клиническиx фармакологов при проведении целенаправленной экспертизы фармакотерапии в рамках реализации программы ДЛО позволяет своевременно выявлять типичные ошибки фармакотерапии и предупреждать избыточное применение препаратов.
Библиографическая ссылка
Гайнуллина Ю.И., Елисеева Е.В., Солодовников В.В., Лозинский Е.Ю. ТИПИЧНЫЕ ДЕФЕКТЫ ФАРМАКОТЕРАПИИ НА АМБУЛАТОРНОМ ЭТАПЕ // Фундаментальные исследования. – 2007. – № 12-1.
– С. 98-98;
URL: https://fundamental-research.ru/ru/article/view?id=3964 (дата обращения: 23.09.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Врачебные ошибки как причина осложнений лекарственной терапии
Статьи
Опубликовано в журнале:
Качественная клиническая практика »» 1 / 2002 В.К. Лепахин*, А.В. Астахова, Е.А. Овчинникова, Л.К. Овчинникова
*Всемирная Организация Здравоохранения (ВОЗ)
Кафедра общей и клинической фармакологии Российского университета дружбы народов, Москва
Проблема осложнений лекарственной терапии становится все более актуальной во всем мире. Это связано прежде всего с внедрением в медицинскую практику большого числа фармакологических препаратов, обладающих высокой биологической активностью, сенсибилизацией населения к биологическим и химическим веществам, нерациональным использованием лекарств, медицинскими ошибками и применением не качественных и фальсифицированных препаратов.
Результаты проведенных за последние годы фармакоэпидемиологических исследований позволяют говорить о том, что недооценка и запоздалое решение этой проблемы чреваты развитием самых серьезных последствий [1, 2].
Масштаб проблемы
В специально проведенных исследованиях было показано, что тяжелые, подчас необратимые осложнения в результате лекарственной терапии развиваются у миллионов людей. Количество летальных исходов, связанных с применением лекарств, исчисляется сотнями тысяч. Только в США ежегодно госпитализируется от 3,5 до 8,8 млн. больных и погибает 100-200 тыс. пациентов вследствие развития неблагоприятных побочных реакций, связанных с применением лекарств [3]. Как вы думаете, в России эта цифра меньше?
Результаты мета-анализа 39 перспективных исследований, проведенных в США в период с 1966 по 1996 гг., показали, что серьезные неблагоприятные побочные реакции возникали в среднем в 6,7% случаев, а летальные осложнения имели место у 0,32% всех госпитализированных больных. Осложнения лекарственной терапии заняли 4-6-е место среди причин смертности после сердечно-сосудистых, онкологических, бронхо-легочных заболеваний и травм [2].
Подобное положение отмечается и в других развитых странах. Так, во Франции в 1997 г. около 10% всех госпитализированных составляли больные с побочными реакциями. Осложнения лекарственной терапии возникли у 1317650 пациентов, из них в 33% случаев — серьезные и в 1,4% — летальные [4]. Неблагоприятные побочные реакции явились причиной госпитализации 5,8% больных в Германии [5].
Согласно данным Pirmohamed и et аl. [6], 5% госпитализаций связаны с лекарственными осложнениями, неблагоприятные побочные реакции возникают у 10-20% госпитализированных больных, осложнения лекарственного генеза стали причиной летальных исходов в 0,1% случаев (для сравнения: летальные исходы в результате хирургических вмешательств наблюдаются в 0,01% случаев).
Неблагоприятные побочные реакции — это не только серьезная медицинская, социальная, но и экономическая проблема.
Экономические затраты, связанные с лекарственными осложнениями, составляют в США около 76,6 млрд. долл. в год [3]. Общие годовые затраты только на лечение предотвратимых осложнений фармакотерапии в США колеблются от 17 до 29 млн. долл.
В Великобритании ежегодно расходуется около 4 млрд. долл. в связи с увеличением продолжительности пребывания в стационарах больных из-за возникших неблагоприятных побочных эффектов лекарств [7].
По данным исследования Moore et аl. (1998), затраты, связанные с побочными реакциями, составляют в разных странах от 5,5 до 17% общего бюджета больниц 181.
Зарубежный опыт изучения проблемы побочного действия лекарств свидетельствует о том, что многие лекарственные осложнения являются следствием медицинских ошибок.
Современное состояние проблемы медицинских ошибок
Неблагоприятные побочные реакции лекарственных препаратов вследствие нерационального применения и врачебных ошибок — это только один из наиболее часто встречающихся видов медицинских ошибок. К медицинским ошибкам относят также:
- неправильную постановку диагноза, приведшую к неверному выбору препарата для лечения
- неиспользование предписанного диагностического обследования;
- неверную интерпретацию результатов обследования;
- непринятие мер после получения результатов, отклоняющихся от нормы;
- использование неисправного медицинского оборудования;
- осложнения при переливании крови;
- невыполнение других медицинских предписаний.
Проблема медицинских ошибок не нова, однако в прошлом на нее не обращали должного внимания. Первые работы, посвященные описанию и изучению проблемы медицинских ошибок, стали появляться в 90-е гг. [9]. Одно из первых значимых исследований этого вопроса было организовано в США Агентством по исследованиям и качеству в здравоохранении и проведено Институтом медицины [10].
По завершении данного исследования в ноябре 1999 г. был составлен отчет, озаглавленный: «Человеку свойственно ошибаться: повышение безопасности в здравоохранении» [11]. В отчете отмечалось, что в результате медицинских ошибок в больницах США ежегодно умирает от 44 000 до 98 000 человек. Это больше, чем смертность в результате автомобильных аварий (43 458), рака молочной железы (42297) или СПИДа (16516).
Согласно полученным данным, только от ошибок, связанных с неправильным применением лекарств, ежегодно погибает 7000 человек; это на 16% больше, чем смертность в результате производственного травматизма [11].
С медицинскими ошибками связаны огромные финансовые издержки. В отчете Института медицины отмечается, что медицинские ошибки обходятся США примерно в 37,7 млрд. долл. в год, причем из них около 17 млрд. долл. связаны с расходами, которые можно было предотвратить. Приблизительно половины этих средств расходуется на лечение последствий предотвратимых медицинских ошибок [11].
Реакция на полученные Институтом медицины данные последовала со стороны руководства страны на самом высоком уровне уже в декабре 1999 г. Президент США Билл Клинтон Исполнительным распоряжением создал Межведомственную рабочую группу по координации качества в здравоохранении и потребовал от нее представить ему в течение 60 дней рекомендации, направленные на повышение степени безопасности больных. Разработанные Президентской комиссией рекомендации были выпущены Белым Домом 22 февраля 2000 г. [12].
Вслед за этим многие страны, включая Канаду, Нидерланды, Новую Зеландию, Швецию и другие, начали специальные национальные программы по исследованию качества оказания медицинской помощи и безопасности пациентов.
Департамент здравоохранения Великобритании в докладе за 2000 г. отметил, что неблагоприятные последствия медицинских вмешательств составили 850 тыс. случаев и явились причиной 10% всех госпитализаций [7].
Исследование качества медицинской помощи в Австралии в 1995 г. показало, что неблагоприятные побочные эффекты имели место у 16,6% госпитализированных больных [13].
Учитывая глобальный характер проблемы медицинских ошибок. Исполнительный комитет Всемирной Организации Здравоохранения (ВОЗ) в январе 2002 г. рассмотрел специальную резолюцию «Качество здравоохранения и безопасность больных» и утвердил Стратегию по повышению безопасности больных, в которой наметил основные меры по улучшению качества оказания медицинской помощи населению [14].
В резолюции Исполнительного комитета ВОЗ отмечается, что, «несмотря на возрастающий интерес к проблеме безопасности больных, в мире еще нет осознания чрезвычайной важности проблемы неблагоприятных побочных реакций». В основном это связано с недостаточностью специальных исследований и фактических данных поданному вопросу.
ВОЗ призывает страны к более активному международному сотрудничеству в этой области.
Ошибки врачей при фармакотерапии
Проблема медицинских ошибок вообще и врачебных ошибок при лекарственной терапии в частности до настоящего времени в России практически не изучалась. Медицинские работники и руководители лечебно-профилактических учреждений стараются избегать обсуждения данной темы; она редко находит отражение на страницах медицинской печати. Между тем, врядли будет преувеличением сказать, что эта проблема актуальна и для нашей страны.
К числу врачебных ошибок, как составляющей медицинских ошибок относят все случаи, связанные с использованием лекарственных препаратов с нарушениями инструкции по медицинскому применению [15].
По данным Classen et аl. [1], полученным при активном мониторинге использования лекарств в стационаре, среди типов врачебных ошибок в медицинской практике лидирующими являются ошибки выбора врачом лекарственного препарата и его дозы. Такого типа ошибки составили 56%. Второе место заняли врачебные ошибки, связанные с некорректным изменением дозы и длительностью применения лекарственных средств — 34%. Наделю неблагоприятных побочных эффектов из-за ошибок, допущенных средним медицинским персоналом и фармацевтическими работниками больничной аптеки, приходилось 10% неблагоприятных побочных эффектов.
Неблагоприятные побочные реакции, возникающие в результате врачебных ошибок, являются потенциально предотвратимыми, поскольку их можно избежать при рациональном использовании лекарственных средств.
Основу профилактики неблагоприятных побочных эффектов лекарственных препаратов, в том числе связанных с врачебными ошибками, составляет их выявление, последующий анализ и разработка предложений по решению проблемы. Решения указанных задач возложено на организованные в большинстве стран мира специальные службы контроля безопасности лекарств (фармаконадзора).
Службы контроля безопасности лекарств.
После «талидомидовой трагедии» в 60-е гг. в разных странах стали создаваться специальные службы фармаконадзора с целью выявления и профилактики осложнений лекарственной терапии. Основу этих служб составляли национальные центры по изучению побочного действия лекарств. В 1969 г. в Советском Союзе был организован Всесоюзный центр по изучению побочного действия лекарств Минздрава СССР, выполняющий весьма важные функции по выявлению, анализу и систематизации сообщений о побочных реакциях, подготовке предложений для Минздрава СССР об ограничении или запрещении применения отдельных препаратов, а также по предоставлению медицинским и фармацевтическим работникам информации по вопросам безопасности лекарственных средств и профилактики возникновения лекарственных осложнений.
После распада СССР в течение 6 лет в России не было национального центра по контролю безопасности лекарств. Часть функций центра в течение указанного времени выполнял Фонд по изучению эффективности и безопасности лекарств, организованный на базе кафедры общей и клинической фармакологии Российского Университета дружбы народов, основным научным направлением которой является изучение вопросов безопасности лекарств и их рационального применения.
В 1997 г., благодаря усилиям сотрудников кафедры общей и клинической фармакологии РУДН, Минздрав России создал на ее базе Федеральный центр по изучению побочных действий лекарств. Центр организовал и возглавил работу по созданию в России службы фармаконадзора, основными задачами которой являются выявление неблагоприятных побочных реакций, разработка предложений по их профилактике и обеспечение медицинской общественности соответствующей информацией [16].
За короткий срок на территории Российской Федерации было создано несколько региональных центров по изучению побочных действий лекарств. Эти центры являются первичным звеном в процессе сбора и оценки сообщений о побочных реакциях лекарств, а также распространения информации о возможных осложнениях лекарственной терапии. В настоящее время в различных регионах России действует 29 таких центров.
Работа Федерального центра получила высокую оценку Всемирной Организации Здравоохранения (ВОЗ) и в конце 1997 г. Россия была принята в качестве полноправного члена в Программу ВОЗ по международному мониторингу лекарств.
В результате последующей реорганизации с 1999 г. функции Федерального центра выполняет отдел токсикологии и изучения побочных действий лекарств Института доклинической и клинической экспертизы лекарств Научного центра экспертизы и государственного контроля лекарственных средств Минздрава РФ.
Юридические основы контроля безопасности лекарств в нашей стране были заложены в «Законе о лекарственных средствах», принятом в 1998 г. В ст. 41 Закона указывается, что «субъекты обращения лекарственных средств обязаны сообщать федеральному органу исполнительной власти в сфере здравоохранения, органам исполнительной власти субъектов Российской Федерации в сфере здравоохранения, федеральному органу контроля качества лекарственных средств и территориальным органам контроля качества лекарственных средств обо всех случаях побочных действий и об особенностях взаимодействия лекарств с другими лекарственными препаратами, которые не соответствуют сведениям о лекарственных средствах, содержащимся в инструкциях по их применению».
Сообщения, поступающие в виде заполненных индивидуальных карт учета НПР, подвергаются всестороннему анализу и заносятся в специальную базу данных [17].
Результаты анализа сообщений о НПР в России
С целью выяснения роли врачебных ошибок в возникновении неблагоприятных побочных реакций был проведен анализ спонтанных сообщений, поступивших в Центр за 1997-2000 гг.
В результате анализа 565 сообщений было установлено, что на долю сведений о лекарственных осложнениях вследствие врачебных ошибок приходилось 27,4%.
Выявлены следующие типы врачебных ошибок (рис. 1):
- непереносимость лекарственного препарата в прошлом;
- неоправданный выбор лекарственного средства, в том числе в результате их назначения при наличии противопоказаний к применению;
- ошибки дозирования препарата, включающие передозировку в случае назначения одного и того же препарата под разными названиями, либо превышения суточной дозы в условиях монотерапии;
- одновременное применение двух и более препаратов одной группы;
- одновременное применение двух и более препаратов разных групп без учета их взаимодействия.
Рисунок 1. Распределение сообщений по группам в зависимости от типа врачебных ошибок
Неоправданный выбор лекарственных средств, связанный с игнорированием противопоказаний к применению, — второй по частоте тип врачебных ошибок.
Меньшая часть ошибок-связана с передозировкоП при назначении одного и того же препарата под разными фирменными наименованиями.
Максимальное число ошибок (73,6%) былодопуще но врачами при комбинированной терапии. Это подтверждают данные литературы, согласно которым риск лекарственных осложнений возрастает пропорционально увеличению числа одновременно назначаемых препаратов. Например, при одновременном применении 2-4 лекарств риск развития побочных реакций увеличивается до 4%, 15-20 лекарственных препаратов — до 54% [18].
Анализ сообщений в данном исследовании показал, что 20% из них содержали сведения о том, что больные получали 12 лекарственных препаратов одномоментно, 40,9% — 8 лекарственных средств.
В условиях монотерапии чаще всего причиной возникновения неблагоприятных побочных эффектов в результате ошибок врачей были противомикробные (в основном антибиотики разных групп), нестероидные противовоспалительные, сердечно-сосудистые и местно-анестезирующие лекарственные средства.
Наиболее частыми нерациональными комбинациями лекарственных средств являлись:
- применение двух и более нестероидных противовоспалительных средств на фоне гастрита и язвенной болезни, что приводило к обострению хронической патологии и/или развитию желудочно-кишечных кровотечений;
- комбинации антибиотиков группы аминогликозидов и других нефротоксических средств (например, цефалоспоринов) с развитием острой почечной недостаточности;
- назначение комбинации ЛС, обладающих раздражающим действием на слизистую желудочно-кишечного тракта (например, аспирина, агапурина и эскузана);
- использование комбинации препаратов, способных вызывать агранулоцитоз (например, левомицетин и фенилбутазон).
Из числа спонтанных сообщений с информацией о развитии неблагоприятных побочных реакций вследствие ошибок врачей 78,7% составили сообщения о серьезных лекарственных осложнениях, из которых 4,2% закончились летально.
Сравнительный анализ числа серьезных побочных реакций, возникших в связи с врачебными ошибками, и в остальных случаях (в которых ошибок врачей не было) выявил большую встречаемость их в прецедентах несоблюдения рекомендаций инструкций по медицинскому использованию лекарств (рис. 2).
Рисунок 2. Распределение сообщений о серьезных побочных реакциях лекарств, возникших в результате врачебных ошибок и в других случаях
К категории серьезных неблагоприятных реакций, согласно принятой ВОЗ терминологии, относятся реакции, которые приводят к летальным исходам, представляют угрозу для жизни, приводят к госпитализации больных или удлиняют ее сроки, тератогенные и канцерогенные эффекты лекарственных средств.
Выявленные серьезные лекарственные осложнения вследствие ошибок врачей клинически проявлялись:
- аллергическими реакциями (22,4% числа врачебных ошибок), включавшими анафилактические шоки, синдромы Стивенса-Джонсона и Лайелла, отеки Квинке, бронхоспазмы и различные виды сыпи;
- сердечно-сосудистыми реакциями (12,0% от чиcла сообщений с врачебными ошибками) в виде коллапса, преходящей ишемии и инфаркта миокарда, аритмий, асистолий, изменений артериального давления, тромбофлебитов, и острого отека мозга;
- нарушениями деятельности ЦНС (2,7% числа сообщений с ошибками врачей) — судороги, галлюцинации, острый психоз, дискоординация движений;
- поражениями желудочно-кишечного тракта (7,7% числа сообщений с врачебными ошибками) в виде обострения хронического гастрита, желудочно-кишечных кровотечений, обострений язвенной болезни желудка, и профузной диареи;
- нарушениями системы кроветворения и гемостаза (7,1% числа сообщений с ошибками врачей): геморрагический синдром, гипохромная анемия и внутренние кровотечения, панцитопения и агранулоцитоз, гипохромная анемия;
- поражениями почек (2,2% числа сообщений с врачебными ошибками) в виде острой почечной недостаточности;
- снижением слуха и остроты зрения (1,1 и 0,6% случаев количества сообщений с ошибками врачей соответственно);
- поражениями печени (4,4% числа сообщений с врачебными ошибками), проявлявшимися гепатотоксическими реакциями и гепатитами;
- прочими осложнениями (18,6% случаев количества сообщений с ошибками врачей), например маточными кровотечениями, некрозом слизистой ротовой полости, синдромом Рея, иммуноденрессантными реакциями, которые явились причиной развития сепсиса, рецидивирующего фурункулеза и абсцесса корня языка и др.
Среди лекарств, вызвавших анафилактический шок. были препараты разных групп, однако на долю местно-анестезирующих средств приходилось большее число сообщений, затем следовали антибактериальные, НПВС и комбинированные препараты.
Обращает на себя внимание нерациональное использование антибиотиков и прежде всего аминогликозидной группы (гентамицина, канамицина, амикацина), которые применялись у больных с наличием противопоказаний, без учета неблагоприятных последствий взаимодействия. В результате у больных развивались острая почечная недостаточность и нефриты.
Приведем некоторые клинические примеры врачебных ошибок.
Случай 1. Больная Ш., 71 года, находясь в стационаре с диагнозом «пневмония», получала комбинированную лекарственную терапию, включающую гентамицин в разовой дозе 80 мг 3 раза в сутки по поводу пневмонии, эуфиллин по 200 мг трижды в сутки, фуросемид по 40 мг в день для коррекции артериального давления (страдает гипертонической болезнью). Через 10 дней после начала терапии развилась острая почечная недостаточность с летальным исходом. В анамнезе — хронический пиелонефрит, гипертоническая болезнь.
В данном случае имеет место врачебная ошибка, так как не был принят во внимание факт повышения нефротоксичности гентамицина при одновременном применении этого препарата с фуросемидом у больной с факторами риска — старческий возраст и хронический пиелонефрит в анамнезе. Информация о взаимодействии препаратов содержится в соответствующих разделах инструкции по их применению.
Случай 2. Больному С., 57 лет, в плановом порядке была проведена эндоскопическая холецистэктомия. В послеоперационном периоде назначена комбинированная лекарственная терапия, включающая: гепарин по 5000 ЕД 4 раза в сутки, фраксипарин (надропарин кальций) по 300 ЕД один раз в сутки подкожно, ципрофлоксацин по 200 мг дважды в сутки, цефантрал (цефотаксим) по 1 г 2 раза в сутки, рибоксин (инозин) по 10 мг 3 раза в день внутривенно. Спустя двое суток состояние больного осложнилось кровотечением из ложа желчного пузыря (тромбоциты — 68 х 109/л, время свертывания цельной крови — 44 мин). Проведена релапаротомия. После операции больной находился в коме в течение недели с признаками прогрессирующей пневмонии и отека мозга. Смерть наступила спустя 15 сут после проведенной плановой операции. Из анамнеза известно, что 6 лет назад пациенту была произведена операция по поводу сложного порока сердца и в течение последних 6 лет он постоянно получал терапию антикоагулянтом непрямого действия — фенилином (фениндоин) по 0,03 2 раза в сутки.
В данном случае возникшее у больного кровотечение с последующим летальным исходом могло быть результатом того, что не было принято во внимание несколько факторов риска развития кровотечения:
- не учтен прием пациентом в течение длительного времени антикоагулянтного препарата длительного действия, способного вызывать кровотечение; на фоне терапии фенилином больному в послеоперационном периоде назначена терапия прямыми антикоагулянтами гепарином и фраксипарином;
- не учтено, что все цефалоспорины могут вызывать гипопрoтромбинемию за счет влияния на протромбиновое время и торможения синтеза витамина К, что может приводить к кровотечениям и кровоизлияниям. Именно с этим связаны рекомендации проводить определение протромбинового времени у больных, получающих препараты данной группы, и назначать витамин К для коррекции гипопротромбинемии. Пожилые и ослабленные пациенты, а также больные с дефицитом витамина К составляют особую группу риска;
- не учтено взаимодействие цефотаксима с гепарином. В результате одновременное применение нескольких препаратов, влияющих на свертывающую систему крови, привело к фатальному исходу.
Случай 3. Ребенку 2-месячного возраста назначен фуразолидон (по 1/4 таблетки — доза не указана — 3 раза в день) для лечения дисбактериоза, который, как отмечал педиатр, проявлялся жидким стулом (без патологических примесей). Через 5 дней от начала лечения препаратом у ребенка выявлены желтушность кожных покровов, повышение уровня ферментов печени.
Ребенок поступил в стационар для исключения врожденного гепатита. При УЗИ обнаружено увеличение печени (в динамике +1 см; +1,5 см; +2 см). Эхоструктура однородна. Показатели функции печени: в 2 раза повышение содержания АЛТ, диспротеинемия, билирубин — 25,1 мкмоль/л (за счет непрямого билирубина).
Из анамнеза известно, что в течение 1 мес после рождения у ребенка отмечалась желтушность кожных покровов, ему были назначены активированный уголь и сульфат магния перорально. Затем в связи с появлением жидкого стула участковый врач назначил фуразолидон для коррекции кишечных нарушений.
В результате отмены препарата и проведенного лечения липоевой кислотой, витамином Е, сорбитом, димедролом состояние ребенка нормализовалось, и показатели функции печени пришли к норме. Диагноз врожденного гепатита был отвергнут.
Анализ данного случая позволяет предположить, что поражение печени было вызвано фуразолидоном. В пользу лекарственного происхождения осложнения свидетельствовали улучшение состояния и регресс симптомов после отмены препарата. Известно, что фуразолидон является высокотоксичным препаратом, способным поражать многие органы, в том числе и печень. Обращает на себя внимание то, что препарат назначен для лечения дисбактериоза — заболевания, которого нег в перечне показаний к назначению фуразолидона.
У ребенка появился жидкий стул без патологических примесей. Нельзя исключить, что причиной его возникновения был сульфат магния, который обладает слабительными свойствами. Остается неясным, на каком основании поставлен диагноз «дисбактериоз» и почему для его коррекции выбран фуразолидон.
В данном случае не было учтено и то, что фуразолидон не рекомендуется применять у детей до 1 месяца из-за риска развития гемолитической анемии вследствие недостаточного развития ферментных систем у таких детей.
И хотя препарат был назначен ребенку двух месяцев, нельзя исключить наличия у него ферментной недостаточности, так как у больного отмечались признаки отягощенного анамнеза, что могло способствовать развитию данного осложнения.
Таким образом, результаты проведенного исследования свидетельствуютотом, что проблема НПР в результате ошибок врачей весьма актуальна для практического здравоохранения России. Примерно треть всех лекарственных осложнений можно считать ятрогенными, причем большинство из них является серьезными, требующими госпитализации или ее продления, приводящими к стойкой потере или снижению трудоспособности (инвалидности), представляющие угрозу для жизни и даже приведшие к смерти больных.
Если учесть тот факт, что сообщаемость о случаях возникновения НПРв нашей стране чрезвычайно мала и значительно уступает таковой в странах с развитой системой контроля безопасности лекарств (число сообщений на численность населения), то правомерно предположить, что мы имеем гораздо большее количество лекарственных осложнений, в том числе и связанных с ошибками врачей.
Основные направления в решении проблемы профилактики осложнений лекарственной терапии, связанных с врачебными ошибками
Анализ специальных исследований, посвященных вопросу изучения медицинских ошибок вообще и ошибок врачей в назначении лекарственных средств в частности, свидетельствует о том, что в их основе лежат недостатки системы подготовки и усовершенствования медицинских кадров в области фармакотерапии, несвоевременное и недостаточное предоставление медицинским и фармацевтическим работникам необходимой информации о возможных неблагоприятных побочных эффектах медикаментов, а также недостатки в организации и функционировании систем контроля безопасности лекарств [14, 15, 19].
Результаты проведенной нами работы позволяют предположить, что в основном те же причины определяют осложнения фармакотерапии и в нашей стране.
Для решения проблемы осложнений фармакотерапии вследствие врачебных ошибок нам представляется целесообразным предложить следующие три основные направления:
1. Совершенствование преподавания фармакологии и клинической фармакологии в медицинских институтах (академиях, университетах) и институтах (академиях) усовершенствования врачей. При этом необходимо не только совершенствование соответствующих программ, но и методических приемов обучения. Студент и врач должны не только получить определенные знания. но и научиться ориентироваться в огромном числе поступающих на фармацевтический рыноклекарственных препаратов с тем, чтобы уметь рационально выбрать и грамотно назначать лекарство конкре гному больному.
2. Предоставление медицинским и фармацевтическим работникам здравоохранения объективной независимой информации о возможных неблагоприятных реакциях на лекарственные средства, включая сведения о взаимодействии лекарств друг с другом и с биологически активными веществами.
3. Совершенствование системы контроля безопасности лекарств как на федеральном и региональном уровнях, так и непосредственно влечебно-профилактических учреждениях. При этом весьма важным является наряду с использованием метода спонтанных сообщений внедрение в практику таких современных методов выявления неблагоприятных побочных эффектов лекарственных средств, как активный мониторинг, анализ реестров и баз данных, содержащих сведения о заболеваемости и смертности, анализ зависимости осложнений фармакотерапии от потребления лекарств.
В заключение необходимо отметить, что в изучении ятрогенных осложнений лекарственной терапии и их профилактике ведущую роль должны играть медицинские и фармацевтические работники практического здравоохранения. Ни в коем случае нельзя «загонять» проблему ошибок при фармакотерапии вглубь и прятать ее.
Практика и отдельные исследования показали, что именно боязнь обвинения в некомпетентности и возможного наказания больше всего препятствуют активному участию в этой работе большинства специалистов [20]. В связи с этим на всех уровнях системы здравоохранения должна быть создана деловая доброжелательная атмосфера экспертизы сообщений об осложнениях лекарственной терапии с целью выявления наиболее типичных ошибок, причин их возникновения и разработки мер их предотвращения, а не с целью наказания за прошлые ошибки.
Участие врачей, медицинских сестер, провизоров и фармацевтов в этой работе является их гражданским и профессиональным долгом и в конечном итоге может спасти жизнь и сохранить здоровье тысячам людей. Не случайно в «Этическом кодексе врача», одобренном на II Пироговском съезде, сказано, что сообщение о побочных действиях лекарств является профессиональным долгом медицинского работника.
Abstract
The problem of adverse drug events is very actual problem I at present. Its prevalence causes deep concernment in practitioners and patients. The popularization of spontaneous messages method is the first attempt in this course. Besides that it is impossible to solve the problem of medical mistakes without medical society involvement. That is why this problem requires a big attention and the specialist’s employment. One of the main factors is the practitioner’s activity in the accounts of adverse drug effects and medical mistakes. Only such information might be the base of recommendations for medical workers and can prevent ialrogenic drug complications.
Литература:
1. Quality of Health Care in America Committee. The Institute of Medicine Report on Medical Errors: Misunderstanding Can Do Harm. Med. Gen. Med., September 19, 2000.
2. Seeger J.D., Kong S.X., Schumock G. T. Characteristics associated with ability to prevent adverse-drug reactions in hospitalized patients. Pharmacotherapy, 1998, Nov-Dec, 18(6), 1284-1289.
3. Johnson J.A., Bootman J.L. Drug-related morbidity and mortality. A cost-of-illness model // J. Arch. Intern. Med., 1995, Oct. 9; 155 (18), 1949-1956.
4. Imbs J.L., Pouyanne P., Haramburu F. et al. Jatrogenic medication: estimation of its prevalence in French public hospitals. Regional Centers ol Pharmacuvigiaincc. Therapie 1999; 54 (1), 21-27.
5. Muehlberger N., Schneeweis S., Hasford J. ADRs Monitoringt Pharmacoepidemiology and drug safety, 1997, 6, Suppl.3, 71-77.
6. Pirmohamed U., Breskenridge A.M., Kiteringham N.R. et al. Adverse drug reactions. BMJ, 1998, 316, 1295-1298.
7. UK Department of Health. An organization with a memory. 2000, December.
8. Moore N.D., Lecaintre D., Noblet C. et al. Frequency and cost of serious adverse drug reactions in a department of general medicine. Br. J. Clin. Pharmacol. 1998, 45 (3), 301-308.
9. Leape L., Brennan Т., Laird N. etal. The nature of adverse events in hospitalized patients: Results of the Harvard Medical Practice Study. New Engl. // J. Med., 1991, 324, 377-384.
10. Billings С. Incident reporting systems in medicine and experience with the aviation safety reporting systems. A Tale of Two Stories: (contrasting Views of Patient Safety. National Patient Safety Foundation, American Medical Association, Chicago Illinois, 1998.
11. Olsen P.M., Lorentzen H., Thomsen K., Fogtmann A. Medication errors in a pediatric department. Ugeskr. Laeger. 1997, Apr 14, 159 (16), 2392-2395.
12. Adverse Drug Events. Substantial problem but magnitude uncertain. US General Accounting Office. 2000, February, 1-12.
13. Wllson R., Runciman W., Gibberd R. et al. The quality in Australian health care study. Med. J. Aust., 1995, 163, 458-471.
14. Quality of Care Patient Safety. WHO, 2002, Resolution EB, 109, 16.
15. Thomas P., Lombardi D. Closing the Loop — Implementing Quality Improvement Processes and Advances in Technology to Decrease Medication Errors. FASHP.
16. Астахова A.B., Лепахин В.К. Проблемы безопасности лекарственных средств в России // Фармацевтический мир, 1997, №2, 10-12.
17. V Российский национальный конгресс «Человек и лекарство» // Безопасность лекарств. 1998, № 2, с. 14-15.
18. Истратов С.Ю., Брайцева Е.В., Вартанян И.Р. Взаимодействие лекарственных средств // Новая аптека, 2000, № 9, с. 34-38.
19. Vincent С., Knox E. Clinical risk modification, quality, and patient safety: interrelationships, problems, and future potential. Best. Pract. Benchmarking. Healthc. 1997, Nov-Dec, 2(6), 221-226.
20. Williams D., Kelly A., Feely J. Drug interactions avoided a useful indicator of good prescribing practice. Br. J. Clin. Pharmacol. 2000, Apr. 49(4), 369-372.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
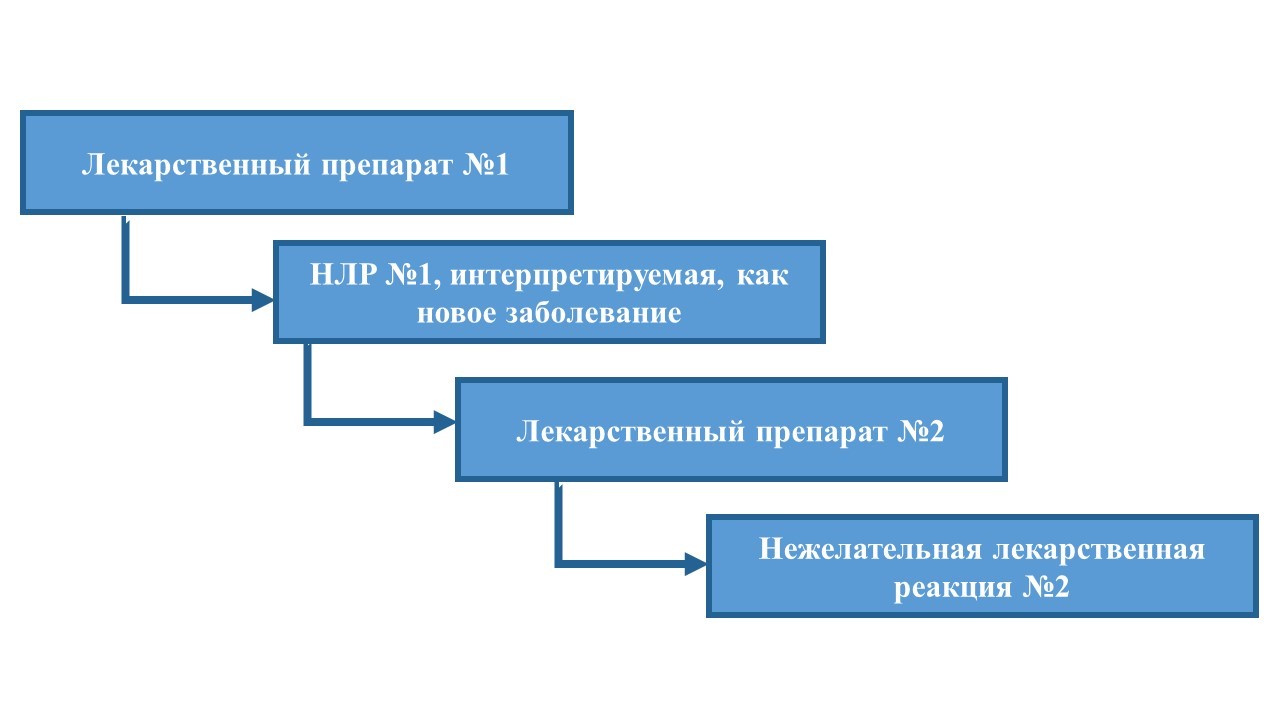
Ошибки при назначении лекарственных средств способствуют увеличению заболеваемости и смертности. По приблизительным оценкам эти ошибки обходятся системе здравоохранения США примерно в 177 миллиардов долларов (в зависимости от определения) в год. Ошибки при назначении лекарственных средств могут включать:
-
Неправильный выбор лекарственного средства, назначение его в неадекватной дозе, неверный режим дозирования и/или длительность курса терапии
-
Ошибочное прочтение рецепта сотрудником аптеки, в результате чего отпускается неправильный препарат либо его дозировка
-
Ошибочное прочтение упаковки сотрудником аптеки, в результате чего отпускается неправильный препарат либо его дозировка
-
Неверные указания пациенту
-
Неправильное введение препарата медицинским работником или пациентом
-
Неправильное хранение препарата сотрудником аптеки или пациентом, что приводит к снижению его активности
-
Использование лекарственного средства с истекшим сроком годности, что приводит к снижению его активности
-
Неправильный прием лекарственного средства пациентом
-
Неточная передача информации, указанной в рецепте, между различными поставщиками
Ошибки в назначении лекарственных средств весьма часты, особенно у определенных категорий пациентов. Этому риску особенно подвержены лица пожилого возраста, женщины детородного возраста и дети. Лекарственные взаимодействия особенно часто встречаются у пациентов, принимающих несколько препаратов. Для снижения риска необходимо знать все принимаемые пациентом препараты (включая назначенные другими врачами и отпускаемые без рецепта) и поддерживать их список актуальным. Пациентов следует поощрять составлять и обновлять список принимаемых ими на данный момент препаратов и дозировок и брать список с собой на каждый врачебный прием или при обращении в отделение неотложной помощи. Если есть какие-либо сомнения относительно препаратов, принимаемых пациентами, им нужно разъяснить необходимость принести все свои препараты на врачебный прием для пересмотра.
Назначения должны быть написаны максимально четко. Названия некоторых препаратов похожи, что может вызвать путаницу, если они будут написаны неразборчиво. Изменение некоторых традиционных сокращений, которые легко перепутать, также может способствовать уменьшению количества ошибок. Например, «qd» (1 раз в день) можно перепутать с «qid» (4 раза в день). Написание «1 раз/день» или «один раз в день» является предпочтительным. Рецепты, переданные в электронном виде или распечатанные на принтере, могут исключить проблемы с неразборчивым почерком или несоответствующими сокращениями. Тем не менее, электронные системы назначения лекарств, в которых используются поля для галочки или прокручиваемые списки, могут увеличить риск непреднамеренно ошибочного выбора лекарства или дозы.
Ошибки при назначении лекарственных средств возможны и в лечебных учреждениях. В частности, препарат может быть выдан не тому больному, не в то время, либо ошибочно назначен не тот способ его введения. Некоторые препараты должны вводиться внутривенно медленно; некоторые – нельзя вводить параллельно. При выявлении подобных ошибок необходимо немедленно информировать врача и получить консультацию у провизора. Электронные системы отпуска препаратов снижают вероятность таких ошибок.
Фармацевт должен хранить лекарственные препараты таким образом, что обеспечить их активность. Аптеки, продающие лекарства по почте, должны следовать регламенту, чтобы обеспечить надлежащую перевозку. Зачастую пациенты хранят препараты неправильно. Шкафчик в ванной комнате не является идеальным местом для хранения лекарственных препаратов из-за повышенной температуры и влажности. Если препараты хранятся неправильно, скорее всего их активность снизится задолго до указанной даты истечения срока годности.
На упаковке должно быть четко указано, следует ли хранить препарат в холодильнике или в прохладном месте, оберегая от воздействия высоких температур или солнечных лучей, либо соблюдая специальные условия хранения. С другой стороны, ненужные меры предосторожности снижают вероятность соблюдения предписанного режима терапии и приводят к ненужному расходу времени пациента. Например, инсулин в запечатанной упаковке должен храниться в холодильнике; однако открытый флакон можно хранить длительное время вне холодильника, в месте, исключающем воздействие чрезмерно высоких температур или прямых солнечных лучей.
Использование лекарственных средств с истекшим сроком годности довольно распространено. Просроченные препараты могут быть неэффективными, а некоторые из них (например, ацетилсалициловая кислота или тетрациклин) могут представлять опасность по истечении срока годности.
Ошибки при назначении лекарственных средств часто возникают из-за отсутствия у пациентов информации о том, как правильно принимать препарат. В результате они могут ошибочно принять не тот препарат, либо неправильную дозу препарата. Инструкции по дозировке каждого препарата, в том числе причины, по которым препарат был назначен, должны быть полностью объяснены пациентам и, по возможности, представлены в письменном виде. Им следует посоветовать обратится к фармацевтическому работнику за дополнительной консультацией по поводу приема прописанного лекарства. Упаковка должна быть удобной, но безопасной. Если у детей не будет доступа к препарату, и у пациентов могут возникнуть проблемы с открыванием контейнера, лекарства не следует предоставлять в контейнерах с защитой от детей.
Другой распространенной причиной ошибок является неточная передача информации, указанной в рецепте, при переводе пациента из одного учреждения в другое или передаче от одного врача другому (например, из больницы в реабилитационный центр, из дома престарелых в больницу или от врача-специалиста – медработнику, оказывающему первичную медицинскую помощь). Связь между разными поставщиками медицинских услуг, загруженными работой, как правило, требует активного усилия, и при переводе пациента изменения в схеме назначений являются распространенным явлением. Повышенное внимание к средствам связи может помочь уменьшить риск таких ошибок. Риск был сокращен с помощью различных программ формального согласования лекарств, таких как подготовка полного списка текущих лекарств каждый раз при переводе пациента из одного учреждения в другое.
ПРИМЕЧАНИЕ:
Это — Профессиональная версия.
ПОЛЬЗОВАТЕЛИ:
Просмотреть пользовательскую версию

Авторское право © 2023 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.

Врачебные ошибки как причина осложнений лекарственной терапии
Статьи
Опубликовано в журнале:
Качественная клиническая практика »» 1 / 2002 В.К. Лепахин*, А.В. Астахова, Е.А. Овчинникова, Л.К. Овчинникова
*Всемирная Организация Здравоохранения (ВОЗ)
Кафедра общей и клинической фармакологии Российского университета дружбы народов, Москва
Проблема осложнений лекарственной терапии становится все более актуальной во всем мире. Это связано прежде всего с внедрением в медицинскую практику большого числа фармакологических препаратов, обладающих высокой биологической активностью, сенсибилизацией населения к биологическим и химическим веществам, нерациональным использованием лекарств, медицинскими ошибками и применением не качественных и фальсифицированных препаратов.
Результаты проведенных за последние годы фармакоэпидемиологических исследований позволяют говорить о том, что недооценка и запоздалое решение этой проблемы чреваты развитием самых серьезных последствий [1, 2].
Масштаб проблемы
В специально проведенных исследованиях было показано, что тяжелые, подчас необратимые осложнения в результате лекарственной терапии развиваются у миллионов людей. Количество летальных исходов, связанных с применением лекарств, исчисляется сотнями тысяч. Только в США ежегодно госпитализируется от 3,5 до 8,8 млн. больных и погибает 100-200 тыс. пациентов вследствие развития неблагоприятных побочных реакций, связанных с применением лекарств [3]. Как вы думаете, в России эта цифра меньше?
Результаты мета-анализа 39 перспективных исследований, проведенных в США в период с 1966 по 1996 гг., показали, что серьезные неблагоприятные побочные реакции возникали в среднем в 6,7% случаев, а летальные осложнения имели место у 0,32% всех госпитализированных больных. Осложнения лекарственной терапии заняли 4-6-е место среди причин смертности после сердечно-сосудистых, онкологических, бронхо-легочных заболеваний и травм [2].
Подобное положение отмечается и в других развитых странах. Так, во Франции в 1997 г. около 10% всех госпитализированных составляли больные с побочными реакциями. Осложнения лекарственной терапии возникли у 1317650 пациентов, из них в 33% случаев — серьезные и в 1,4% — летальные [4]. Неблагоприятные побочные реакции явились причиной госпитализации 5,8% больных в Германии [5].
Согласно данным Pirmohamed и et аl. [6], 5% госпитализаций связаны с лекарственными осложнениями, неблагоприятные побочные реакции возникают у 10-20% госпитализированных больных, осложнения лекарственного генеза стали причиной летальных исходов в 0,1% случаев (для сравнения: летальные исходы в результате хирургических вмешательств наблюдаются в 0,01% случаев).
Неблагоприятные побочные реакции — это не только серьезная медицинская, социальная, но и экономическая проблема.
Экономические затраты, связанные с лекарственными осложнениями, составляют в США около 76,6 млрд. долл. в год [3]. Общие годовые затраты только на лечение предотвратимых осложнений фармакотерапии в США колеблются от 17 до 29 млн. долл.
В Великобритании ежегодно расходуется около 4 млрд. долл. в связи с увеличением продолжительности пребывания в стационарах больных из-за возникших неблагоприятных побочных эффектов лекарств [7].
По данным исследования Moore et аl. (1998), затраты, связанные с побочными реакциями, составляют в разных странах от 5,5 до 17% общего бюджета больниц 181.
Зарубежный опыт изучения проблемы побочного действия лекарств свидетельствует о том, что многие лекарственные осложнения являются следствием медицинских ошибок.
Современное состояние проблемы медицинских ошибок
Неблагоприятные побочные реакции лекарственных препаратов вследствие нерационального применения и врачебных ошибок — это только один из наиболее часто встречающихся видов медицинских ошибок. К медицинским ошибкам относят также:
- неправильную постановку диагноза, приведшую к неверному выбору препарата для лечения
- неиспользование предписанного диагностического обследования;
- неверную интерпретацию результатов обследования;
- непринятие мер после получения результатов, отклоняющихся от нормы;
- использование неисправного медицинского оборудования;
- осложнения при переливании крови;
- невыполнение других медицинских предписаний.
Проблема медицинских ошибок не нова, однако в прошлом на нее не обращали должного внимания. Первые работы, посвященные описанию и изучению проблемы медицинских ошибок, стали появляться в 90-е гг. [9]. Одно из первых значимых исследований этого вопроса было организовано в США Агентством по исследованиям и качеству в здравоохранении и проведено Институтом медицины [10].
По завершении данного исследования в ноябре 1999 г. был составлен отчет, озаглавленный: «Человеку свойственно ошибаться: повышение безопасности в здравоохранении» [11]. В отчете отмечалось, что в результате медицинских ошибок в больницах США ежегодно умирает от 44 000 до 98 000 человек. Это больше, чем смертность в результате автомобильных аварий (43 458), рака молочной железы (42297) или СПИДа (16516).
Согласно полученным данным, только от ошибок, связанных с неправильным применением лекарств, ежегодно погибает 7000 человек; это на 16% больше, чем смертность в результате производственного травматизма [11].
С медицинскими ошибками связаны огромные финансовые издержки. В отчете Института медицины отмечается, что медицинские ошибки обходятся США примерно в 37,7 млрд. долл. в год, причем из них около 17 млрд. долл. связаны с расходами, которые можно было предотвратить. Приблизительно половины этих средств расходуется на лечение последствий предотвратимых медицинских ошибок [11].
Реакция на полученные Институтом медицины данные последовала со стороны руководства страны на самом высоком уровне уже в декабре 1999 г. Президент США Билл Клинтон Исполнительным распоряжением создал Межведомственную рабочую группу по координации качества в здравоохранении и потребовал от нее представить ему в течение 60 дней рекомендации, направленные на повышение степени безопасности больных. Разработанные Президентской комиссией рекомендации были выпущены Белым Домом 22 февраля 2000 г. [12].
Вслед за этим многие страны, включая Канаду, Нидерланды, Новую Зеландию, Швецию и другие, начали специальные национальные программы по исследованию качества оказания медицинской помощи и безопасности пациентов.
Департамент здравоохранения Великобритании в докладе за 2000 г. отметил, что неблагоприятные последствия медицинских вмешательств составили 850 тыс. случаев и явились причиной 10% всех госпитализаций [7].
Исследование качества медицинской помощи в Австралии в 1995 г. показало, что неблагоприятные побочные эффекты имели место у 16,6% госпитализированных больных [13].
Учитывая глобальный характер проблемы медицинских ошибок. Исполнительный комитет Всемирной Организации Здравоохранения (ВОЗ) в январе 2002 г. рассмотрел специальную резолюцию «Качество здравоохранения и безопасность больных» и утвердил Стратегию по повышению безопасности больных, в которой наметил основные меры по улучшению качества оказания медицинской помощи населению [14].
В резолюции Исполнительного комитета ВОЗ отмечается, что, «несмотря на возрастающий интерес к проблеме безопасности больных, в мире еще нет осознания чрезвычайной важности проблемы неблагоприятных побочных реакций». В основном это связано с недостаточностью специальных исследований и фактических данных поданному вопросу.
ВОЗ призывает страны к более активному международному сотрудничеству в этой области.
Ошибки врачей при фармакотерапии
Проблема медицинских ошибок вообще и врачебных ошибок при лекарственной терапии в частности до настоящего времени в России практически не изучалась. Медицинские работники и руководители лечебно-профилактических учреждений стараются избегать обсуждения данной темы; она редко находит отражение на страницах медицинской печати. Между тем, врядли будет преувеличением сказать, что эта проблема актуальна и для нашей страны.
К числу врачебных ошибок, как составляющей медицинских ошибок относят все случаи, связанные с использованием лекарственных препаратов с нарушениями инструкции по медицинскому применению [15].
По данным Classen et аl. [1], полученным при активном мониторинге использования лекарств в стационаре, среди типов врачебных ошибок в медицинской практике лидирующими являются ошибки выбора врачом лекарственного препарата и его дозы. Такого типа ошибки составили 56%. Второе место заняли врачебные ошибки, связанные с некорректным изменением дозы и длительностью применения лекарственных средств — 34%. Наделю неблагоприятных побочных эффектов из-за ошибок, допущенных средним медицинским персоналом и фармацевтическими работниками больничной аптеки, приходилось 10% неблагоприятных побочных эффектов.
Неблагоприятные побочные реакции, возникающие в результате врачебных ошибок, являются потенциально предотвратимыми, поскольку их можно избежать при рациональном использовании лекарственных средств.
Основу профилактики неблагоприятных побочных эффектов лекарственных препаратов, в том числе связанных с врачебными ошибками, составляет их выявление, последующий анализ и разработка предложений по решению проблемы. Решения указанных задач возложено на организованные в большинстве стран мира специальные службы контроля безопасности лекарств (фармаконадзора).
Службы контроля безопасности лекарств.
После «талидомидовой трагедии» в 60-е гг. в разных странах стали создаваться специальные службы фармаконадзора с целью выявления и профилактики осложнений лекарственной терапии. Основу этих служб составляли национальные центры по изучению побочного действия лекарств. В 1969 г. в Советском Союзе был организован Всесоюзный центр по изучению побочного действия лекарств Минздрава СССР, выполняющий весьма важные функции по выявлению, анализу и систематизации сообщений о побочных реакциях, подготовке предложений для Минздрава СССР об ограничении или запрещении применения отдельных препаратов, а также по предоставлению медицинским и фармацевтическим работникам информации по вопросам безопасности лекарственных средств и профилактики возникновения лекарственных осложнений.
После распада СССР в течение 6 лет в России не было национального центра по контролю безопасности лекарств. Часть функций центра в течение указанного времени выполнял Фонд по изучению эффективности и безопасности лекарств, организованный на базе кафедры общей и клинической фармакологии Российского Университета дружбы народов, основным научным направлением которой является изучение вопросов безопасности лекарств и их рационального применения.
В 1997 г., благодаря усилиям сотрудников кафедры общей и клинической фармакологии РУДН, Минздрав России создал на ее базе Федеральный центр по изучению побочных действий лекарств. Центр организовал и возглавил работу по созданию в России службы фармаконадзора, основными задачами которой являются выявление неблагоприятных побочных реакций, разработка предложений по их профилактике и обеспечение медицинской общественности соответствующей информацией [16].
За короткий срок на территории Российской Федерации было создано несколько региональных центров по изучению побочных действий лекарств. Эти центры являются первичным звеном в процессе сбора и оценки сообщений о побочных реакциях лекарств, а также распространения информации о возможных осложнениях лекарственной терапии. В настоящее время в различных регионах России действует 29 таких центров.
Работа Федерального центра получила высокую оценку Всемирной Организации Здравоохранения (ВОЗ) и в конце 1997 г. Россия была принята в качестве полноправного члена в Программу ВОЗ по международному мониторингу лекарств.
В результате последующей реорганизации с 1999 г. функции Федерального центра выполняет отдел токсикологии и изучения побочных действий лекарств Института доклинической и клинической экспертизы лекарств Научного центра экспертизы и государственного контроля лекарственных средств Минздрава РФ.
Юридические основы контроля безопасности лекарств в нашей стране были заложены в «Законе о лекарственных средствах», принятом в 1998 г. В ст. 41 Закона указывается, что «субъекты обращения лекарственных средств обязаны сообщать федеральному органу исполнительной власти в сфере здравоохранения, органам исполнительной власти субъектов Российской Федерации в сфере здравоохранения, федеральному органу контроля качества лекарственных средств и территориальным органам контроля качества лекарственных средств обо всех случаях побочных действий и об особенностях взаимодействия лекарств с другими лекарственными препаратами, которые не соответствуют сведениям о лекарственных средствах, содержащимся в инструкциях по их применению».
Сообщения, поступающие в виде заполненных индивидуальных карт учета НПР, подвергаются всестороннему анализу и заносятся в специальную базу данных [17].
Результаты анализа сообщений о НПР в России
С целью выяснения роли врачебных ошибок в возникновении неблагоприятных побочных реакций был проведен анализ спонтанных сообщений, поступивших в Центр за 1997-2000 гг.
В результате анализа 565 сообщений было установлено, что на долю сведений о лекарственных осложнениях вследствие врачебных ошибок приходилось 27,4%.
Выявлены следующие типы врачебных ошибок (рис. 1):
- непереносимость лекарственного препарата в прошлом;
- неоправданный выбор лекарственного средства, в том числе в результате их назначения при наличии противопоказаний к применению;
- ошибки дозирования препарата, включающие передозировку в случае назначения одного и того же препарата под разными названиями, либо превышения суточной дозы в условиях монотерапии;
- одновременное применение двух и более препаратов одной группы;
- одновременное применение двух и более препаратов разных групп без учета их взаимодействия.
Рисунок 1. Распределение сообщений по группам в зависимости от типа врачебных ошибок
Неоправданный выбор лекарственных средств, связанный с игнорированием противопоказаний к применению, — второй по частоте тип врачебных ошибок.
Меньшая часть ошибок-связана с передозировкоП при назначении одного и того же препарата под разными фирменными наименованиями.
Максимальное число ошибок (73,6%) былодопуще но врачами при комбинированной терапии. Это подтверждают данные литературы, согласно которым риск лекарственных осложнений возрастает пропорционально увеличению числа одновременно назначаемых препаратов. Например, при одновременном применении 2-4 лекарств риск развития побочных реакций увеличивается до 4%, 15-20 лекарственных препаратов — до 54% [18].
Анализ сообщений в данном исследовании показал, что 20% из них содержали сведения о том, что больные получали 12 лекарственных препаратов одномоментно, 40,9% — 8 лекарственных средств.
В условиях монотерапии чаще всего причиной возникновения неблагоприятных побочных эффектов в результате ошибок врачей были противомикробные (в основном антибиотики разных групп), нестероидные противовоспалительные, сердечно-сосудистые и местно-анестезирующие лекарственные средства.
Наиболее частыми нерациональными комбинациями лекарственных средств являлись:
- применение двух и более нестероидных противовоспалительных средств на фоне гастрита и язвенной болезни, что приводило к обострению хронической патологии и/или развитию желудочно-кишечных кровотечений;
- комбинации антибиотиков группы аминогликозидов и других нефротоксических средств (например, цефалоспоринов) с развитием острой почечной недостаточности;
- назначение комбинации ЛС, обладающих раздражающим действием на слизистую желудочно-кишечного тракта (например, аспирина, агапурина и эскузана);
- использование комбинации препаратов, способных вызывать агранулоцитоз (например, левомицетин и фенилбутазон).
Из числа спонтанных сообщений с информацией о развитии неблагоприятных побочных реакций вследствие ошибок врачей 78,7% составили сообщения о серьезных лекарственных осложнениях, из которых 4,2% закончились летально.
Сравнительный анализ числа серьезных побочных реакций, возникших в связи с врачебными ошибками, и в остальных случаях (в которых ошибок врачей не было) выявил большую встречаемость их в прецедентах несоблюдения рекомендаций инструкций по медицинскому использованию лекарств (рис. 2).
Рисунок 2. Распределение сообщений о серьезных побочных реакциях лекарств, возникших в результате врачебных ошибок и в других случаях
К категории серьезных неблагоприятных реакций, согласно принятой ВОЗ терминологии, относятся реакции, которые приводят к летальным исходам, представляют угрозу для жизни, приводят к госпитализации больных или удлиняют ее сроки, тератогенные и канцерогенные эффекты лекарственных средств.
Выявленные серьезные лекарственные осложнения вследствие ошибок врачей клинически проявлялись:
- аллергическими реакциями (22,4% числа врачебных ошибок), включавшими анафилактические шоки, синдромы Стивенса-Джонсона и Лайелла, отеки Квинке, бронхоспазмы и различные виды сыпи;
- сердечно-сосудистыми реакциями (12,0% от чиcла сообщений с врачебными ошибками) в виде коллапса, преходящей ишемии и инфаркта миокарда, аритмий, асистолий, изменений артериального давления, тромбофлебитов, и острого отека мозга;
- нарушениями деятельности ЦНС (2,7% числа сообщений с ошибками врачей) — судороги, галлюцинации, острый психоз, дискоординация движений;
- поражениями желудочно-кишечного тракта (7,7% числа сообщений с врачебными ошибками) в виде обострения хронического гастрита, желудочно-кишечных кровотечений, обострений язвенной болезни желудка, и профузной диареи;
- нарушениями системы кроветворения и гемостаза (7,1% числа сообщений с ошибками врачей): геморрагический синдром, гипохромная анемия и внутренние кровотечения, панцитопения и агранулоцитоз, гипохромная анемия;
- поражениями почек (2,2% числа сообщений с врачебными ошибками) в виде острой почечной недостаточности;
- снижением слуха и остроты зрения (1,1 и 0,6% случаев количества сообщений с ошибками врачей соответственно);
- поражениями печени (4,4% числа сообщений с врачебными ошибками), проявлявшимися гепатотоксическими реакциями и гепатитами;
- прочими осложнениями (18,6% случаев количества сообщений с ошибками врачей), например маточными кровотечениями, некрозом слизистой ротовой полости, синдромом Рея, иммуноденрессантными реакциями, которые явились причиной развития сепсиса, рецидивирующего фурункулеза и абсцесса корня языка и др.
Среди лекарств, вызвавших анафилактический шок. были препараты разных групп, однако на долю местно-анестезирующих средств приходилось большее число сообщений, затем следовали антибактериальные, НПВС и комбинированные препараты.
Обращает на себя внимание нерациональное использование антибиотиков и прежде всего аминогликозидной группы (гентамицина, канамицина, амикацина), которые применялись у больных с наличием противопоказаний, без учета неблагоприятных последствий взаимодействия. В результате у больных развивались острая почечная недостаточность и нефриты.
Приведем некоторые клинические примеры врачебных ошибок.
Случай 1. Больная Ш., 71 года, находясь в стационаре с диагнозом «пневмония», получала комбинированную лекарственную терапию, включающую гентамицин в разовой дозе 80 мг 3 раза в сутки по поводу пневмонии, эуфиллин по 200 мг трижды в сутки, фуросемид по 40 мг в день для коррекции артериального давления (страдает гипертонической болезнью). Через 10 дней после начала терапии развилась острая почечная недостаточность с летальным исходом. В анамнезе — хронический пиелонефрит, гипертоническая болезнь.
В данном случае имеет место врачебная ошибка, так как не был принят во внимание факт повышения нефротоксичности гентамицина при одновременном применении этого препарата с фуросемидом у больной с факторами риска — старческий возраст и хронический пиелонефрит в анамнезе. Информация о взаимодействии препаратов содержится в соответствующих разделах инструкции по их применению.
Случай 2. Больному С., 57 лет, в плановом порядке была проведена эндоскопическая холецистэктомия. В послеоперационном периоде назначена комбинированная лекарственная терапия, включающая: гепарин по 5000 ЕД 4 раза в сутки, фраксипарин (надропарин кальций) по 300 ЕД один раз в сутки подкожно, ципрофлоксацин по 200 мг дважды в сутки, цефантрал (цефотаксим) по 1 г 2 раза в сутки, рибоксин (инозин) по 10 мг 3 раза в день внутривенно. Спустя двое суток состояние больного осложнилось кровотечением из ложа желчного пузыря (тромбоциты — 68 х 109/л, время свертывания цельной крови — 44 мин). Проведена релапаротомия. После операции больной находился в коме в течение недели с признаками прогрессирующей пневмонии и отека мозга. Смерть наступила спустя 15 сут после проведенной плановой операции. Из анамнеза известно, что 6 лет назад пациенту была произведена операция по поводу сложного порока сердца и в течение последних 6 лет он постоянно получал терапию антикоагулянтом непрямого действия — фенилином (фениндоин) по 0,03 2 раза в сутки.
В данном случае возникшее у больного кровотечение с последующим летальным исходом могло быть результатом того, что не было принято во внимание несколько факторов риска развития кровотечения:
- не учтен прием пациентом в течение длительного времени антикоагулянтного препарата длительного действия, способного вызывать кровотечение; на фоне терапии фенилином больному в послеоперационном периоде назначена терапия прямыми антикоагулянтами гепарином и фраксипарином;
- не учтено, что все цефалоспорины могут вызывать гипопрoтромбинемию за счет влияния на протромбиновое время и торможения синтеза витамина К, что может приводить к кровотечениям и кровоизлияниям. Именно с этим связаны рекомендации проводить определение протромбинового времени у больных, получающих препараты данной группы, и назначать витамин К для коррекции гипопротромбинемии. Пожилые и ослабленные пациенты, а также больные с дефицитом витамина К составляют особую группу риска;
- не учтено взаимодействие цефотаксима с гепарином. В результате одновременное применение нескольких препаратов, влияющих на свертывающую систему крови, привело к фатальному исходу.
Случай 3. Ребенку 2-месячного возраста назначен фуразолидон (по 1/4 таблетки — доза не указана — 3 раза в день) для лечения дисбактериоза, который, как отмечал педиатр, проявлялся жидким стулом (без патологических примесей). Через 5 дней от начала лечения препаратом у ребенка выявлены желтушность кожных покровов, повышение уровня ферментов печени.
Ребенок поступил в стационар для исключения врожденного гепатита. При УЗИ обнаружено увеличение печени (в динамике +1 см; +1,5 см; +2 см). Эхоструктура однородна. Показатели функции печени: в 2 раза повышение содержания АЛТ, диспротеинемия, билирубин — 25,1 мкмоль/л (за счет непрямого билирубина).
Из анамнеза известно, что в течение 1 мес после рождения у ребенка отмечалась желтушность кожных покровов, ему были назначены активированный уголь и сульфат магния перорально. Затем в связи с появлением жидкого стула участковый врач назначил фуразолидон для коррекции кишечных нарушений.
В результате отмены препарата и проведенного лечения липоевой кислотой, витамином Е, сорбитом, димедролом состояние ребенка нормализовалось, и показатели функции печени пришли к норме. Диагноз врожденного гепатита был отвергнут.
Анализ данного случая позволяет предположить, что поражение печени было вызвано фуразолидоном. В пользу лекарственного происхождения осложнения свидетельствовали улучшение состояния и регресс симптомов после отмены препарата. Известно, что фуразолидон является высокотоксичным препаратом, способным поражать многие органы, в том числе и печень. Обращает на себя внимание то, что препарат назначен для лечения дисбактериоза — заболевания, которого нег в перечне показаний к назначению фуразолидона.
У ребенка появился жидкий стул без патологических примесей. Нельзя исключить, что причиной его возникновения был сульфат магния, который обладает слабительными свойствами. Остается неясным, на каком основании поставлен диагноз «дисбактериоз» и почему для его коррекции выбран фуразолидон.
В данном случае не было учтено и то, что фуразолидон не рекомендуется применять у детей до 1 месяца из-за риска развития гемолитической анемии вследствие недостаточного развития ферментных систем у таких детей.
И хотя препарат был назначен ребенку двух месяцев, нельзя исключить наличия у него ферментной недостаточности, так как у больного отмечались признаки отягощенного анамнеза, что могло способствовать развитию данного осложнения.
Таким образом, результаты проведенного исследования свидетельствуютотом, что проблема НПР в результате ошибок врачей весьма актуальна для практического здравоохранения России. Примерно треть всех лекарственных осложнений можно считать ятрогенными, причем большинство из них является серьезными, требующими госпитализации или ее продления, приводящими к стойкой потере или снижению трудоспособности (инвалидности), представляющие угрозу для жизни и даже приведшие к смерти больных.
Если учесть тот факт, что сообщаемость о случаях возникновения НПРв нашей стране чрезвычайно мала и значительно уступает таковой в странах с развитой системой контроля безопасности лекарств (число сообщений на численность населения), то правомерно предположить, что мы имеем гораздо большее количество лекарственных осложнений, в том числе и связанных с ошибками врачей.
Основные направления в решении проблемы профилактики осложнений лекарственной терапии, связанных с врачебными ошибками
Анализ специальных исследований, посвященных вопросу изучения медицинских ошибок вообще и ошибок врачей в назначении лекарственных средств в частности, свидетельствует о том, что в их основе лежат недостатки системы подготовки и усовершенствования медицинских кадров в области фармакотерапии, несвоевременное и недостаточное предоставление медицинским и фармацевтическим работникам необходимой информации о возможных неблагоприятных побочных эффектах медикаментов, а также недостатки в организации и функционировании систем контроля безопасности лекарств [14, 15, 19].
Результаты проведенной нами работы позволяют предположить, что в основном те же причины определяют осложнения фармакотерапии и в нашей стране.
Для решения проблемы осложнений фармакотерапии вследствие врачебных ошибок нам представляется целесообразным предложить следующие три основные направления:
1. Совершенствование преподавания фармакологии и клинической фармакологии в медицинских институтах (академиях, университетах) и институтах (академиях) усовершенствования врачей. При этом необходимо не только совершенствование соответствующих программ, но и методических приемов обучения. Студент и врач должны не только получить определенные знания. но и научиться ориентироваться в огромном числе поступающих на фармацевтический рыноклекарственных препаратов с тем, чтобы уметь рационально выбрать и грамотно назначать лекарство конкре гному больному.
2. Предоставление медицинским и фармацевтическим работникам здравоохранения объективной независимой информации о возможных неблагоприятных реакциях на лекарственные средства, включая сведения о взаимодействии лекарств друг с другом и с биологически активными веществами.
3. Совершенствование системы контроля безопасности лекарств как на федеральном и региональном уровнях, так и непосредственно влечебно-профилактических учреждениях. При этом весьма важным является наряду с использованием метода спонтанных сообщений внедрение в практику таких современных методов выявления неблагоприятных побочных эффектов лекарственных средств, как активный мониторинг, анализ реестров и баз данных, содержащих сведения о заболеваемости и смертности, анализ зависимости осложнений фармакотерапии от потребления лекарств.
В заключение необходимо отметить, что в изучении ятрогенных осложнений лекарственной терапии и их профилактике ведущую роль должны играть медицинские и фармацевтические работники практического здравоохранения. Ни в коем случае нельзя «загонять» проблему ошибок при фармакотерапии вглубь и прятать ее.
Практика и отдельные исследования показали, что именно боязнь обвинения в некомпетентности и возможного наказания больше всего препятствуют активному участию в этой работе большинства специалистов [20]. В связи с этим на всех уровнях системы здравоохранения должна быть создана деловая доброжелательная атмосфера экспертизы сообщений об осложнениях лекарственной терапии с целью выявления наиболее типичных ошибок, причин их возникновения и разработки мер их предотвращения, а не с целью наказания за прошлые ошибки.
Участие врачей, медицинских сестер, провизоров и фармацевтов в этой работе является их гражданским и профессиональным долгом и в конечном итоге может спасти жизнь и сохранить здоровье тысячам людей. Не случайно в «Этическом кодексе врача», одобренном на II Пироговском съезде, сказано, что сообщение о побочных действиях лекарств является профессиональным долгом медицинского работника.
Abstract
The problem of adverse drug events is very actual problem I at present. Its prevalence causes deep concernment in practitioners and patients. The popularization of spontaneous messages method is the first attempt in this course. Besides that it is impossible to solve the problem of medical mistakes without medical society involvement. That is why this problem requires a big attention and the specialist’s employment. One of the main factors is the practitioner’s activity in the accounts of adverse drug effects and medical mistakes. Only such information might be the base of recommendations for medical workers and can prevent ialrogenic drug complications.
Литература:
1. Quality of Health Care in America Committee. The Institute of Medicine Report on Medical Errors: Misunderstanding Can Do Harm. Med. Gen. Med., September 19, 2000.
2. Seeger J.D., Kong S.X., Schumock G. T. Characteristics associated with ability to prevent adverse-drug reactions in hospitalized patients. Pharmacotherapy, 1998, Nov-Dec, 18(6), 1284-1289.
3. Johnson J.A., Bootman J.L. Drug-related morbidity and mortality. A cost-of-illness model // J. Arch. Intern. Med., 1995, Oct. 9; 155 (18), 1949-1956.
4. Imbs J.L., Pouyanne P., Haramburu F. et al. Jatrogenic medication: estimation of its prevalence in French public hospitals. Regional Centers ol Pharmacuvigiaincc. Therapie 1999; 54 (1), 21-27.
5. Muehlberger N., Schneeweis S., Hasford J. ADRs Monitoringt Pharmacoepidemiology and drug safety, 1997, 6, Suppl.3, 71-77.
6. Pirmohamed U., Breskenridge A.M., Kiteringham N.R. et al. Adverse drug reactions. BMJ, 1998, 316, 1295-1298.
7. UK Department of Health. An organization with a memory. 2000, December.
8. Moore N.D., Lecaintre D., Noblet C. et al. Frequency and cost of serious adverse drug reactions in a department of general medicine. Br. J. Clin. Pharmacol. 1998, 45 (3), 301-308.
9. Leape L., Brennan Т., Laird N. etal. The nature of adverse events in hospitalized patients: Results of the Harvard Medical Practice Study. New Engl. // J. Med., 1991, 324, 377-384.
10. Billings С. Incident reporting systems in medicine and experience with the aviation safety reporting systems. A Tale of Two Stories: (contrasting Views of Patient Safety. National Patient Safety Foundation, American Medical Association, Chicago Illinois, 1998.
11. Olsen P.M., Lorentzen H., Thomsen K., Fogtmann A. Medication errors in a pediatric department. Ugeskr. Laeger. 1997, Apr 14, 159 (16), 2392-2395.
12. Adverse Drug Events. Substantial problem but magnitude uncertain. US General Accounting Office. 2000, February, 1-12.
13. Wllson R., Runciman W., Gibberd R. et al. The quality in Australian health care study. Med. J. Aust., 1995, 163, 458-471.
14. Quality of Care Patient Safety. WHO, 2002, Resolution EB, 109, 16.
15. Thomas P., Lombardi D. Closing the Loop — Implementing Quality Improvement Processes and Advances in Technology to Decrease Medication Errors. FASHP.
16. Астахова A.B., Лепахин В.К. Проблемы безопасности лекарственных средств в России // Фармацевтический мир, 1997, №2, 10-12.
17. V Российский национальный конгресс «Человек и лекарство» // Безопасность лекарств. 1998, № 2, с. 14-15.
18. Истратов С.Ю., Брайцева Е.В., Вартанян И.Р. Взаимодействие лекарственных средств // Новая аптека, 2000, № 9, с. 34-38.
19. Vincent С., Knox E. Clinical risk modification, quality, and patient safety: interrelationships, problems, and future potential. Best. Pract. Benchmarking. Healthc. 1997, Nov-Dec, 2(6), 221-226.
20. Williams D., Kelly A., Feely J. Drug interactions avoided a useful indicator of good prescribing practice. Br. J. Clin. Pharmacol. 2000, Apr. 49(4), 369-372.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Аннотация
Высокий риск развития нежелательных лекарственных реакций среди пациентов пожилого и старческого возраста обусловлен несколькими причинами. Во‑первых, возраст‑ассоциированные изменения органов и систем приводят к соответствующим изменениям фармакокинетики и фармакодинамики лекарственных средств и, как следствие, к атипичному течению нежелательных лекарственных реакций. Во‑вторых, полиморбидность, зачастую имеющаяся у данной категории пациентов, обусловливает явление полипрагмазии, тем самым обостряя аспект межлекарственных взаимодействий – одного из факторов риска развития нежелательных лекарственных реакций. Наконец, низкая осведомленность представителей практического здравоохранения в этом вопросе становится причиной развития «фармакологических каскадов». При активном внедрении гериатрической фармакологии в практическое здравоохранение улучшится не только прогноз для данной когорты пациентов, но и качество их жизни.
Ключевые слова
Для цитирования:
Сафроненко А.В., Ганцгорн Е.В., Сафроненко В.А., Кузнецов И.И., Сухорукова Н.В., Криштопа А.В., Осипова А.В. Особенности фармакотерапии пациентов пожилого и старческого возраста. Южно-Российский журнал терапевтической практики. 2021;2(4):6-15. https://doi.org/10.21886/2712-8156-2021-2-4-6-15
For citation:
Safronenko A.V., Gantsgorn E.V., Safronenko V.A., Kuznetsov I.I., Sukhorukova N.V., Krishtopa A.V., Osipova A.A. Features of pharmacotherapy at elderly and senile patients. South Russian Journal of Therapeutic Practice. 2021;2(4):6-15.
(In Russ.)
https://doi.org/10.21886/2712-8156-2021-2-4-6-15
Введение
Социально-экономические процессы в современном обществе обусловливают увеличение продолжительности жизни. Это ведет к «демографическому старению» населения и увеличению доли пожилых людей в нём. Так, согласно прогнозам, доля лиц пожилого возраста к 2050 г. в глобальной популяции будет составлять 21% [1][2].
Наряду с этим популяционный рост количества пожилых людей предопределяет соответствующие требования к качеству их жизни. В данном аспекте особое место, безусловно, занимает качество оказания медицинской помощи и, в частности, фармакотерапия [3][4]. На сегодняшний день в лекарственной терапии лиц пожилого и старческого возраста можно выделить следующие проблемы:
- Изменения фармакокинетики и фармакодинамики, обусловленные анатомо-физиологическими инволютивными изменениями в организме возрастных пациентов.
- Высокий риск не всегда оправданной полипрагмазии среди коморбидных пациентов при ограниченной профилактике нежелательных лекарственных реакций (НЛР).
- Снижение когнитивной сферы и, как следствие, отсутствие равноценного диалога между врачом и пациентом.
- Низкий коплаенс на фоне чрезмерно частого самолечения высокоактивными лекарственными средствами (ЛС).
- Асоциальность лиц пожилого и старческого возраста (одиночество, беспомощность, бедность), а также другие факторы [2-7].
Поиск и разработка путей решения вышеуказанных вопросов безопасности и эффективности медикаментозного лечения этой категории пациентов обусловливает создание нового раздела клинической фармакологии — гериатрической фармакологии [5][8].
Проблема безопасности применения фармакотерапии у лиц пожилого и старческого возраста
Частота встречаемости госпитализаций по поводу НЛР среди жителей развитых и развивающихся стран варьируется в пределах от 3,3 до 11,0% случаев соответственно. Наиболее частыми причинами являются реакции со стороны центральной нервной системы, желудочно-кишечного тракта и сердечно-сосудистой системы. При этом пожилой и старческий возрасты представляют собой один из главных факторов риска развития НЛР [3][9-11].
Согласно данным литературы, обусловлено это высокой коморбидностью (рис. 1) среди пациентов данной группы и, как следствие, высоким риском полипрагмазии (рис. 2), то есть между возрастом пациента, количеством применяемых ЛС и возникновением НЛР имеется прямая зависимость [12][13].
Рисунок 1. Соотношение возраста пациента и числа заболеваний [12]
Рисунок 2. Полипрагмазия среди пациентов разного возраста [13]
Следует отметить, что пациенты пожилого и старческого возраста в целом более чувствительны к НЛР, при этом клиническое их проявление может быть атипичным. Согласно данным мета-анализа, риск развития НЛР у лиц в возрасте 65 лет и старше в 4 раза выше, чем среди взрослого населения. Еще более уязвимы в этом отношении пациенты с гериатрическими синдромами, в том числе с синдромом старческой астении [2][14][15].
Коморбидность имеет место быть у преобладающего большинства пожилых пациентов. По данным зарубежных исследований, у 70–75% лиц пожилого и старческого возраста имеется до 4 нозологических единиц [15][16]. В России можно наблюдать более широкий диапазон — от 5 до 8 сопутствующих заболеваний [2].
Зачастую данное состояние предшествует развитию гериатрических синдромов (головокружение, высокий риск падений, когнитивные дисфункции, недержание мочи и т.д.), течение которых ухудшается при неадекватной фармакотерапии. Вызвано это возрастными изменениями фармакокинетики и фармакодинамики ЛС, некоторые из которых приведены таблице 1 [4][9][17-21].
Таблица 1
Гериатрические синдромы и риск-ассоциированные ЛС
|
Гериатрические синдромы |
ЛС/группы ЛС, обладающие негативным влиянием на течение гериатрических синдромов |
|
Падения |
Седативные, снотворные, антихолинергические, антигипертензивные, антидепрессанты, сахароснижающие, диуретики, ЛС, угнетающие AV-проводимость (бета-адреноблокаторы, недигидропиридиновые блокаторы кальциевых каналов и др.), вазодилятаторы (нитраты и др.) |
|
Снижение когнитивных функций |
Антихолинергические, бензодиазепины, антигистаминные, трициклические антидепрессанты |
|
Недержание мочи |
Альфа-адреноблокаторы, антидепрессанты, седативные, диуретики |
|
Запор |
Антихолинергические, опиатные анальгетики, трициклические антидепрессанты, антагонисты кальция, препараты кальция. |
|
Диарея |
Антибиотики, ингибиторы протонной помпы, аллопуринол, селективные ингибиторы обратного захвата серотонина |
Среднее число ЛС, ежедневно принимаемых пациентами в возрасте от 60 лет и старше в России, варьируется от 5,5 до 6,7 среди физически активных лиц и от 5,3 до 8,2 —среди неактивных. В США от 5 и более ЛС в неделю принимает свыше 40% пожилых пациентов, при этом около 50% пациентов получает хотя бы одно лишнее ЛС. Однако проблема полипрагмазии заключается не только в высокой частоте встречаемости этого явления, но и в корректной интерпретации данной дефиниции [2][3][22][23].
Наиболее корректным является мнение о том, что полипрагамазия представляет собой применение ЛС, которые не показаны при данной нозологии, не имеют доказанной эффективности, а также дублируют эффекты уже назначенных ЛС, например, врачом другой специальности [3][22][23].
Основными причинами полипрагмазии у пожилых являются одновременно ведение одного пациента врачами разных специальностей, многокомпонентные схемы фармакотерапии в виду низкой эффективности монорежимов, некорректные руководства по лечению различных заболеваний, а также ряд социально-экономических факторов (самолечение, «агрессивный» маркетинг ЛС в средствах массовой информации) [22–24].
Несомненно, возраст является фактором риска коморбидности, которая в свою очередь повышает риск полипрагмазии, однако последняя не всегда оправдана в клинической практике. В большинстве случае это приводит лишь к повышению риска развития НЛР. В частности, НЛР у коморбидного пожилого или старческого возраста пациента с полипрагмазией может быть ошибочно принята врачом за новое заболевание, требующее дополнительной фармакологической коррекции (рис. 3) [3][5][6][8][22-26].
Рисунок 3. Каскад развития фармакологической полипрагмазии
Это усугубляет сложившуюся «картину» лекарственного взаимодействия и приводит к развитию «фармакологических каскадов» (например: амлодипин → отеки → фуросемид → гипокалиемия → препараты калия) [2][3][22-24][26].
Проблемы эффективности применения фармакотерапии у лиц пожилого и старческого возраста
К сожалению, данные об особенностях фармакокинетики и фармакодинамики, которые позволили бы оценить эффективность проводимой современной медикаментозной терапии в пожилом возрасте имеются лишь в отношении ограниченного числа ЛС, поскольку большинство из них не были изучены в клинических исследованиях среди пациентов данной группы. На сегодняшний день пожилые пациенты зачастую исключаются из клинических исследований, что осложняет получение новых сведений. Так, по данным исследования PREDICT, было установлено, что из 251 проанализированных исследований по изучению сердечной недостаточности пациенты старшего возраста исключались только на основании возрастного ограничения в 25,5% случаев [27].
Однако возможные варианты изменений фармакокинетики (табл. 2) и фармакодинамики (табл. 3) ЛС у пациентов пожилого и старческого возраста могут быть спрогнозированы на основании анатомо-физиологических иволютивных изменений, затрагивающих абсолютно все органы и системы. В частности:
- для сердечно-сосудистой системы характерны фиброзные и жировые изменения миокарда, отложения амилоида, ослабление чувствительности и количества бета-адренергических рецепторов в миокарде, процессы ремоделирования миокарда и сосудов, кальциноз клапанного аппарата сердца, гиперкоагуляция и склонность к тромбозам [28–34];
- в дыхательной системе происходят инволюция паренхимы лёгких, появление участков ателектаза, старческой эмфизема, антракоза, повышение вентиляции в верхушках лёгких и снижение её в базальных отделах, уменьшение васкуляризации лёгких, уменьшение силы дыхательных мышц, снижение жизненной ёмкости лёгких, остаточного объёма лёгких, увеличение физиологического мертвого пространства легких [35–36];
- для органов желудочно-кишечного тракта (ЖКТ) характерны атрофия слизистой оболочки желудочно-кишечного тракта, потеря зубов, смещение или удлинение пищевода и снижение его эвакуаторной пищевода; нарушение моторной, снижение эвакуаторной и секреторной функции желудка, нарушение моторной, снижение эвакуаторной высасывающей функции кишечника, старческая инволюция стромы поджелудочной железы и паренхимы печени [35-37];
- в выделительной системе наблюдаются старческая инволюция паренхимы печек с гломерулосклерозом, ухудшением почечного кровотока, снижением количества функционирующих нефронов, ремоделированием почечного сосудистого русла [36].
Таблица 2
Некоторые возрастные физиологические изменения, потенциально влияющие на фармакокинетику ЛС [38 –43]
|
Возрастные физиологические изменения |
Влияние на фармакокинетику ЛС |
|
Снижение кислотности |
Снижение абсорбции |
|
Замедление моторики ЖКТ |
Увеличение времени наступления Cmax |
|
Снижение гастроинтестинального кровотока |
Снижение абсорбции из ЖКТ |
|
Снижение печеночного кровотока |
Повышение плазменной концентрации ЛС, обладающих феноменом «первого прохождения» |
|
Снижение уровня плазменных белков |
Повышение AUC для ЛС, вводимых внутривенно с высоким аффинитетом |
|
Увеличение содержания жировой ткани |
Увеличение Т1/2 для липофильных ЛС |
|
Снижение содержания воды |
Увеличение концентрации гидрофильных ЛС |
|
Снижение массы активной печеночной ткани |
Увеличение концентрации ЛС с преимущественной биотрансформацией в печени |
|
Снижение активности оксидативных ферментов и ферментов системы цитохрома Р-450 |
Увеличение концентрации ЛС с преимущественной биотрансформацией в печени |
|
Снижении функции почек |
Увеличение концентрации ЛС с почечной экскрецией |
Таблица 3
Особенности фармакодинамики ЛС у лиц пожилого и старческого возраста [40–43]
|
Особенности фармакодинамики |
Примеры ЛС и их групп |
|
Усиление выраженности эффекта ЛС и НЛР при использовании в терапевтических дозах |
Блокаторы рецепторов к ангиотензину II, варфарин, верапамил, галоперидол, глибенкламид, диазепам, дилтиазем, дифенгидрамин, леводопа, мидазолам, фелодипин, эналаприл, морфин |
|
Уменьшение выраженности эффекта (потребность в более высоких дозах) и увеличение риска НЛР |
Альбутерол, бета-адреноблокаторы, фуросемид |
Важно отметить, что рассмотренные выше анатомо-физиологические изменения у лиц пожилого и старческого возраста затрагивают каждый из этапов фармакокинетики ЛС (табл. 2).
На этапе абсорбции происходят следующие процессы:
- изменение скорости пассивной диффузии;
- изменение биодоступности ЛС;
- уменьшение всасывания ЛС (повышение pH желудочного содержимого может уменьшить всасывание карбоната кальция, который требует кислой среды для оптимального всасывания, что может увеличить риск запоров, поэтому пожилым людям следует рекомендовать препараты кальция в форме солей, например, цитрат кальция);
- снижение скорости активного транспорта ЛС (например, кальция, железа, витаминов);
- замедление абсорбции ЛС при трансдермальном применении и, как следствие, увеличение Tmax (например, бензойная кислота, ацетилсалициловая кислота, кофеин и др.);
На этапе распределения происходят следующие процессы:
- уменьшение объёма распределения и увеличение концентрации в плазме для гидрофильных ЛC;
- увеличение объёма распределения и удлинения T1/2 для липофильных ЛС (например, диазепама, хлордиазепоксида);
- увеличение свободных фракций ЛС, имеющих высокую (>90%) связь с белками плазмы крови (например, при снижении уровня сывороточного альбумина (варфарин, фенитоин)).
На этапе метаболизма происходят следующие процессы:
- изменения I фазы (CYP450-зависимой) печёночного метаболизма (обычно снижается на 30–40%);
- снижение клиренса и увеличение T1/2 для ЛС, метаболизирующихся путём окисления (например, диазепам, теофиллин и др.);
- незначительное изменение клиренса ЛС, которые метаболизируются путём конъюгации и глюкуронирования (реакции II фазы);
- снижение (каждый год на 1% после 40 лет) пресистемного метаболизма (например, нитраты, пропранолол, фенобарбитал, нифедипин и др.);
- увеличение риска образования атипичных метаболитов (парацетамол, спиронолактон и др.);
- увеличение риска гепатоксичных эффектов ЛС (например, нестероидные противовоспалительные средства (НПВС) и др.);
На этапе элиминации происходят следующие процессы:
- снижение клиренса и увеличение T1/2 для ЛС с преимущественно печёночным путем выведения (например, пропранолол, лидокаин и др.);
- снижение клиренса (после 40 лет в среднем на 8 мл/мин./1,73 м2 каждые 10 лет) и увеличение T1/2 ЛС и их метаболитов за счёт снижения скорости клубочковой фильтрации (например, ривароксабан, гепарин, дигоксин, лизиноприл, фуросемид, гидрохлортиазид, канаглифлозин, дапаглифлозин, ситаглиптин, метформин, рисперидон, ЛС лития, ципрофлоксацин, левофлоксацин, тобрамицин, триметоприм, морфин, ранитидин, метоклопрамид, осельтамивир и многие другие ЛС из различных групп) [38–43].
Помимо описанных выше возраст-ассоциированных структурных и функциональных изменений органов и систем, у лиц пожилого возраста могут изменяться количество и чувствительность вне- и внутриклеточных рецепторов в эффекторном органе, способность клеток к ответу при связывании молекулы ЛС с рецептором. Помимо уменьшения количества и снижения чувствительности рецепторов в органах-мишенях, одновременно имеет место их функциональное истощение и снижение реактивности, что приводит к «извращению» фармакодинамики ЛС. Это характеризуется развитием трудно прогнозируемых, нетипичных, порой даже парадоксальных реакций на терапевтическую дозу ЛС. Например, с возрастом снижаются количество и чувствительность бета-адренорецепторов, поэтому возможно снижение эффекта пропранолола и других бета2-агонистов. Кроме того, пожилые пациенты особенно уязвимы в отношении центральных побочных эффектов, что обусловлено изменением количества рецепторов и медиаторов в ЦНС, повышением проницаемости гематоэнцефалического барьера [18][19][21][44–47].
Развитию нетипичных реакций при применении ЛС способствуют также сниженная физическая активность, склонность к запорам, недостаток витаминов, ухудшение кровоснабжения тканей, относительное преобладание процессов возбуждения в нервной системе пожилых людей [3][12][16][36].
Подход к лекарственной терапии пациентов пожилого и старческого возраста
На сегодняшний день, основным источником, регламентирующим назначение адекватной фармакотерапии лицам пожилого и старческого возраста, в том числе и при наличии синдрома старческой астении, является действующие клинические рекомендации от 2018 г. «Фармакотерапия у лиц пожилого и старческого возраста», содержащие алгоритм подбора фармакотерапии для таких пациентов (рис. 4) [24].
Рисунок 4. Алгоритм подбора фармакотерапии пациентов пожилого и старческого возраста с синдромом старческой астении [24]
В соответствии с данным алгоритмом на первом этапе нужно провести краткое интервью не только пациента, но и его родственника для оценки существующих рисков проведения лекарственной терапии, в том числе возможный уровень комплаенса. В последующем врачом должна быть произведена комплексная гериатрическая оценка (скрининговый опросник «Возраст не помеха», определение уровня креатинина, шкала Чайлд-Пью) [6][24][47][48].
При выборе той или иной тактики лекарственной терапии пациента пожилого и старческого возраста следует принимать во внимание наличие других гериатрических синдромов, результаты оценки функционального статуса, когнитивные и эмоциональные нарушения и социальные проблемы [6][24].
Для оценки отношения возможных рисков фармакотерапии и потенциальной её пользы, а также с целью профилактики НЛР рекомендовано использовать STOPP/START критерии, алгоритм «7 шагов», шкалы антихолинергической нагрузки, GerontoNet, BADRI. Каждая из перечисленных шкал имеет свою диагностическую ценность [6][24][49–51].
Цель применения STOPP/START-критериев заключается в получении ясных, основанных на данных доказательной медицины алгоритмов во избежание потенциально неблагоприятного или неоправданного назначения ЛС и для улучшения адекватности лекарственных назначений, предотвращения развития НЛР и снижения стоимости медикаментозной терапии. Шкала содержит в себе два типа критериев — STOPP-критерии (80 критериев) и STАRT-критерии (34 критерия). В частности, STOPP-критерии направлены на скрининг потенциально неадекватных назначений ЛС пожилым пациентам: они позволяют исключить любые ЛС, не имеющие достаточной доказательной базы для их клинического использования; любое ЛС, назначенное сверх рекомендуемой продолжительности применения, когда продолжительность лечения четко определена; любые дублирующие назначения (например, два НПВС, петлевых диуретика, антикоагулянта и т.д.). START-критерии выявляют те ЛС, которые, напротив, неоправданно не были назначены пожилым пациентам (например, если клиническое состояние такого больного расценивается как тяжёлое и требует паллиативной фармакотерапии, то последующие лекарственные назначения следует делать с её учётом, то есть паллиативное лечение отменять нельзя) [24][51].
Алгоритм «7 шагов» снижения риска полипрагмазии при фармакотерапии пожилых и старых пациентов позволяет врачу идентифицировать цели медикаментозного лечения, перечень жизненно важных ЛС, оценить избыточность проводимого медикаментозного лечения, достижения поставленных терапевтических целей у пациента «высокого риска», побочных эффектов ЛС, экономическую доступность лечения, а также определить, способен ли пациент придерживаться рекомендованной схемы лечения (уровень комплаентности) [24][47–50].
Шкала GerontoNet оценки риска НЛР у пациентов пожилого и старческого возраста позволяет проанализировать предшествующие опыт фармакотерапии, сформулировать поведенческие рекомендации для пациента, в том числе особенности приема ЛС или образа жизни во время приема ЛС, осуществлять контроль за функциональным состоянием сердечно-сосудистой системы, почек, печени, системы кроветворения и ЖКТ [24][47–50].
На основании вышеизложенного могут быть сформулированы следующие принципы рациональной фармакотерапии у пациентов пожилого и старческого возраста:
- При назначении медикаментозной терапии следует ориентироваться на чёткие показания к ней (критерии STOPP/START).
- Перед началом и во время её проведения необходимо проводить оценку рисков на основании лекарственного взаимодействия и НЛР, в том числе комплаенса (алгоритм «7 шагов», шкала GerontoNet).
- Производить коррекцию режима дозирования ЛС с учётом биохимических показателей функциональной активности печени и почек.
Выводы
Несмотря на длительное существование гериатрии как науки, масштабы внедрения в клиническую практику гериатрической фармакологии на сегодняшний день только набирают обороты. Обусловлено это не только расширением показаний к медикаментозной терапии среди лиц пожилого и старческого возраста, но и повышением частоты случаев эффективного выявления НЛР.
Несомненно, возрастные инволютивные изменения в органах и системах оказывают влияние на фармакокинетику и фармакодинамику ЛС, повышая тем самым риск развития НЛР. Однако ведущей причиной их развития является низкая осведомлённость медицинских работников в вопросе рациональной фармакотерапии, а также недостаточное использование «инструментов» в целях её оптимизации (комплексная гериатрическая оценка, применение специализированных шкал) в отношении пациентов пожилого и старческого возраста.
Повышение уровня информированности специалистов практического здравоохранения в данном вопросе будет способствовать активному внедрению специальных подходов к фармакотерапии, описанных в данной работе, среди пациентов старших возрастных групп, что, несомненно, снизит частоту НЛР.
Популяризация данного направления также возможно поможет найти ответы на ряд других перспективных направлений в рамках гериатрической фармакологии [2][5][8][24][39–44], таких как следующие:
- Оценка влияние хронической болезни почек на внепочечный метаболизм ЛС.
- Создание рутинного метода оценки печёночного кровотока.
- Изучение фармакодинамики ЛС нового поколения у пациентов старческого и пожилого возраста, в том числе при наличии синдрома старческой астении.
- Оценка роли фармакогеномики.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. GBD 2015 Mortality and Causes of Death Collaborators. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016;388(10053):1459-1544. DOI: 10.1016/S01406736(16)31012-1. Erratum in: Lancet. 2017;389(10064):e1. PMID: 27733281; PMCID: PMC5388903.
2. Ушкалова Е.А., Ткачева О.Н., Рунихина Н.К., Чухарева Н.А., Бевз А.Ю. Особенности фармакотерапии у пожилых пациентов. Введение в проблему. Рациональная фармакотерапия в кардиологии. 2016;12(1):94-100. DOI: 10.20996/1819-6446-2016-12-1-94-100
3. Сычев Д.А., Остроумова О.Д., Кочетков А.И., Переверзев А.П., Остроумова Т.М., Клепикова М.В. и др. Лекарственно-индуцированные заболевания: эпидемиология и актуальность проблемы. Фарматека. 2020;27(5):77–84. DOI: 10.18565/pharmateca.2020.5.77-84
4. Tisdale J.E., Miller D.A. Drug-induced diseases: prevention, detection, and management. 3rd ed. Bethesda, Md.: American Society of Health-System Pharmacists, 2018.
5. Петров В.И. Гериатрическая фармакология. Вестник Волгоградского государственного медицинского университета. 2011;1(37):3-7. Elibrary ID: 16403672
6. Сычев Д.А. Полипрагмазия в клинической практике: проблема и решения. Учебное пособие. 2-е изд., испр. И доп. Спб, 2018.
7. Franck L., Molyneux N., Parkinson L. Systematic review of interventions addressing social isolation and depression in aged care clients. Qual Life Res. 2016;25(6):1395-1407. DOI: 10.1007/s11136-015-1197-y
8. Belovol A.N., Kazakov I.I. Clinical pharmacology in geriatrics. Medix Anti-aging. 2012;1(25):50-55.
9. Angamo M.T., Chalmers L., Curtain C.M., Bereznicki L.R. Adverse-drug-reaction-related hospitalisations in developed and developing countries: a review of prevalence and contributing factors. Drug Saf. 2016;39(9):847—857. DOI: 10.1007/ s40264016-0444-7
10. Hakkarainen K.M., Gyllensten H., Jönsson A.K., Andersson Sundell K., Petzold M., Hägg S. Prevalence, nature and potential pre-ventability of adverse drug events — a population-based medical record study of 4970 adults. Br J Clin Pharmacol. 2014;78(1):170—183. DOI: 10.1111/bcp.12314
11. Tandon V.R., Khajuria V., Mahajan V., Sharma A., Gillani Z., Mahajan A. Drug-induced diseases (dids): An experience of a tertiary care teaching hospital from India. Indian J Med Res. 2015;142(1):33—39. DOI: 10.4103/0971-5916.162093
12. Hanlon P., Nicholl B., Jani B.D., Lee D., mcqueenie R. Frailty and pre-frailty in middle-aged and older adults and its association with multimorbidity and mortality: a prospective analysis of 493 737 UK Biobank participants. The Lancet Public Health. 2018;3(7):e323-e332. DOI: 10.1016/S24682667(18)30091-4
13. Duerden M., Payne R. Polypharmacy – what is it and how common is it? Prescriber. 2014;25(21):44-47.
14. Beijer H.J., de Blaey C.J. Hospitalisati caused by adverse drug reactions (ADR): a meta-analysis of observational studies. Pharm World Sci. 2002;24(2):46-54. DOI: 10.1023/a:1015570104121.
15. National Institute for Health and Care Excellence. Multimorbidity: clinical assessment and management (NICE Guideline 56), 2016.
16. Held FP, Blyth F, Gnjidic D, Hirani V, Naganathan V, Waite LM, et al. Association Rules Analysis of Comorbidity and Multimorbidity: The Concord Health and Aging in Men Project. J Gerontol A Biol Sci Med Sci. 2016;71(5):625-31. DOI: 10.1093/gerona/glv181.
17. Vetrano DL, Foebel AD, Marengoni A, Brandi V, Collamati A, Heckman GA, et al. Chronic diseases and geriatric syndromes: The different weight of comorbidity. Eur J Intern Med. 2016;27:62-7. DOI: 10.1016/j.ejim.2015.10.025.
18. Куликова М.И., Черняева М.С. Влияние полипрагмазии на когнитивные функции пациентов старческого возраста. Медицинский алфавит. 2019;1(3):49-50. Elibrary ID: 37131587
19. Остроумова О.Д., Куликова М.И., Остроумова Т.М., Черняева М.С., Кочетков А.И., Парфенов В.А. Лекарственноиндуцированные когнитивные нарушения. Неврология, нейропсихиатрия, психосоматика. 2020;12(3):11-18. DOI: 10.14412/2074-2711-2020-3-11-18
20. Ильина Е.С., Доскина Е.В., Богова О.Т., Болотокова А.В., Горбатенкова С.В., Головина О.В., и др. Лекарственный аудит, как профилактика падений у пациента старческого возраста. Остеопороз и остеопатии. 2020;23(2):57-58. Elibrary ID: 45432885
21. Ильина Е.С., Шалыгин В.А., Иващенко Д.В., Савельева М.И., Синицина И.И., Семенова Е.П., и др. Падения у коморбидных пациентов старческого возраста при сочетанном применении психотропных и кардиологических лекарственных средств. Нервно-мышечные болезни. 2019;9(1):67-74. DOI: 10.17650/2222-8721-2019-9-1-67-74
22. Maher R.L., Hanlon J., Hajjar E.R. Clinical consequences of polypharmacy in elderly. Expert Opin Drug Saf. 2014;13(1):5765. DOI: 10.1517/14740338.2013.827660.
23. Charlesworth CJ, Smit E, Lee DS, Alramadhan F, Odden MC. Polypharmacy Among Adults Aged 65 Years and Older in the United States: 1988-2010. J Gerontol A Biol Sci Med Sci. 2015;70(8):989-95. DOI: 10.1093/gerona/glv013.
24. Фармакотерапия у лиц пожилого и старческого возраста. Клинические рекомендации МЗ РФ, 2018.
25. Schjøtt J., Andreassen L.M., Dale H., Stokes Ch.L. Review of clinical questions submitted to Norwegian drug information centers concerning administration and dosage to older patients of relevance to patient-centric care. Pharmaceutics. 2021;13(1):105. DOI: 10.3390/pharmaceutics13010105
26. Van der Heyden J, Berete F, Renard F, Vanoverloop J, Devleesschauwer B, De Ridder K, et al. Assessing polypharmacy in the older population: Comparison of a self-reported and prescription based method. Pharmacoepidemiol Drug Saf. 2021;30(12):1716-1726. DOI: 10.1002/pds.5321.
27. Cherubini A, Oristrell J, Pla X, Ruggiero C, Ferretti R, Diestre G, et al. The persistent exclusion of older patients from ongoing clinical trials regarding heart failure. Arch Intern Med. 2011;171(6):550-6. DOI: 10.1001/archinternmed.2011.31.
28. De Almeida AJPO, de Almeida Rezende MS, Dantas SH, de Lima Silva S, de Oliveira JCPL, de Lourdes Assunção Araújo de Azevedo F, et al. Unveiling the Role of Inflammation and Oxidative Stress on Age-Related Cardiovascular Diseases. Oxid Med Cell Longev. 2020;2020:1954398. DOI: 10.1155/2020/1954398.
29. Chinta S.J., Woods G., Rane A., Demaria M., Campisi J., Andersen J.K. Cellular senescence and the aging brain. Exp Gerontol. 2015;68:3-7. DOI: 10.1016/j.exger.2014.09.018
30. Herrera M.D., Mingorance C., Rodríguez-Rodríguez R., Alvarez de Sotomayor M. Endothelial dysfunction and aging: an update. Ageing Res Rev. 2010;9(2):142-152. DOI: 10.1016/j.Arr.2009.07.002
31. Tesauro M., Mauriello A., Rovella V., Annicchiarico-Petruzzel-li M., Cardillo C., Melino G., Di Daniele N. Arterial ageing: from endothelial dysfunction to vascular calcification. J Intern Med. 2017;281(5):471-482. DOI: 10.1111/joim.12605
32. Trindade M., Oigman W., Fritsch Neves M. Potential role of endothelin in early vascular aging. Curr Hypertens Rev. 2017;13(1):33-40. DOI: 10.2174/1573402113666170414165735
33. Neves M.F., Cunha A.R., Cunha M.R., Gismondi R.A., Oigman W. The role of rennin-angiotensin-aldosterone system and its new components in arterial stiffness and vascular aging. High Blood Press Cardiovasc Prev. 2018;25(2):137-145. DOI: 10.1007/s40292-018-0252-5
34. Nusbaum N.J. Aging and sensory senescence. South Med J. 1999;92(3):267-275. DOI: 10.1097/00007611-19990300000002
35. Loh KY, Ogle J. Age related visual impairment in the elderly. Med J Malaysia. 2004;59(4):562-8, quiz 569. PMID: 15779599.
36. Halter J.B., Ouslander J.G., Tinetti M.E., Studenski S., High K.P., Asthana S., eds. Hazzard’s geriatric medicine and gerontology. 6 ed. New York: mcgraw Hill, 2009.
37. Радченко В.Г., Селиверстов П.В. Возрастные изменения печени. Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. 2017;9(1):110-116. Elibrary ID: 29024983
38. Mangoni A.A., Jackson Sh. Age-related changes in pharmacokinetics and pharmacodynamics: basic principles and practical applications. Br J Clin Pharmacol. 2004;57(1):6-14. DOI: 10.1046/j.1365-2125.2003.02007.x
39. Klotz U. Pharmacokinetics and drug metabolism in the elderly. Drug Metab Rev. 2009;41(2):67-76. DOI: 10.1080/03602530902722679
40. Turnheim K. When drug therapy gets old: pharmacokineti and pharmacodynamics in the elderly. Exp Gerontol. 2003;38(8):843-853. DOI: 10.1016/s0531-5565(03)00133-5
41. Bowie M.W., Slattum P.W. Pharmacodynamics in older adults: a review. Am J Geriatr Pharmacother. 2007;5(3):263-303. DOI: 10.1016/j.amjopharm.2007.10.001
42. Triflro G., Spina E. Age-related changes in pharmacodynamics: focus on drugs acting on central nervous and cardiovascular systems. Curr Drug Metab. 2011;12(7):611-620. DOI: 10.2174/138920011796504473
43. Cusack B.J., Vestal R.E. Clinical pharmacology: Special considerations in the elderly. In: Calkins E, Davis PJ, Ford AB, eds. Practice of geriatric medicine. Philadelphia: W.B. Saunders Co.; 1986. P. 115-136.
44. Остроумова О.Д., Черняева М.С., Сычев Д.А. Депрескрайбинг антигипертензивных препаратов у пациентов старших возрастных групп. Рациональная Фармакотерапия в Кардиологии. 2020;16(1):82-93. DOI: 10.20996/1819-6446 -2020-02-14
45. Mattappalil A, Mergenhagen KA. Neurotoxicity with antimicrobials in the elderly: a review. Clin Ther. 2014;36(11):14891511.e4. DOI: 10.1016/j.clinthera.2014.09.020.
46. Molinari E, Spatola C, Pietrabissa G, Pagnini F, Castelnuovo G. The Role of Psychogeriatrics in Healthy Living and Active Ageing. Stud Health Technol Inform. 2014;203:122-33. PMID: 26630519.
47. Mangoni A A., Jarmuzewska A E. Incorporating pharmacokinetic data into personalised prescribing for older people: challenges and opportunities. European Geriatric Medicine. 2021;12(3):435-442. DOI: 10.1007/s41999-020-00437-5
48. Lavan A.H., Gallagher P.F., O’Mahony D. Methods to reduce prescribing errors in elderly patients with multimorbidity. Clin Interv Aging. 2016;11:857-866. DOI: 10.2147/CIA.S80280
49. Samaranayake N.R., Layanthi S., Samaraweera D.G.S., Zumara M.S., Nawarathneraja T.S., Hettihewa M., et al. Assessing the appropriateness of medicines among elderly using the, Modified STOP/START criteria for Sri Lanka. 2018.
50. Drug research and development for adults across the older age span: Proceedings of a Workshop. National Academies Press (US), 2021. DOI: 10.17226/2599
Об авторах
А. В. Сафроненко
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России
Россия
Сафроненко Андрей Владимирович, доктор медицинских наук, доцент, заведующий кафедрой фармакологии и клинической фармакологии
Ростов-на-Дону
Е. В. Ганцгорн
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России
Россия
Ганцгорн Елена Владимировна, кандидат медицинских наук, доцент кафедры фармакологии и клинической фармакологии
Ростов-на-Дону
В. А. Сафроненко
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России
Россия
Сафроненко Виктория Александровна, кандидат медицинских наук, доцент кафедры внутренних болезней № 1
Ростов-на-Дону
И. И. Кузнецов
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России
Россия
Кузнецов Игорь Игоревич, студент, лечебно-профилактический факультет
Ростов-на-Дону
Н. В. Сухорукова
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России
Россия
Сухорукова Наталия Владимировна, кандидат медицинских наук, доцент кафедры фармакологии и клинической фармакологии
Ростов-на-Дону
А. В. Криштопа
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России
Россия
Криштопа Анна Викторовна, кандидат медицинских наук, доцент кафедры фармакологии и клинической фармакологии
Ростов-на-Дону
А. В Осипова
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России
Россия
Осипова Алиса Валерьевна, студент, лечебно-профилактический факультет
Ростов-на-Дону
Проанализирована структура детской заболеваемости за 2015–2021 гг. и структура обращений в медицинские организации г. Москвы амбулаторного типа для обоснования дизайна фармакоэкономического исследования затрат на лечение детей.
Проблема безопасного и эффективного применения лекарств актуальна для всех стран. Ошибки при фармакотерапии могут наблюдаться на всех четырех этапах использования лекарств, включая назначение ЛС (39 % ошибок, неправильный выбор препарата (препаратов), назначение без учета противопоказаний, без оценки эффективности и переносимости ЛП и т. д.), передачу информации о назначении (12 %) (нечеткие, неразборчивые записи, сокращения в листах назначения и т. д.), ошибки дозирования, разведения (11 %), ошибки на этапе использования (прием, введение, 38 %) — несвоевременное введение ЛС, неправильный путь введения, отсутствие контроля в эффективности лечения, недооценка важности информирования пациента о побочных эффектах и правилах приема лекарств. Ошибки в назначении психотропных препаратов опасны развитием серьезных побочных эффектов, в то же время они являются предотвратимыми, в связи с чем их выявление, анализ и профилактика повторных случаев является актуальной. Цель исследования — проанализировать основные ошибки фармакотерапии у пациентов наркологического профиля за период с апреля 2021 г. по апрель 2022 г.
Цель исследования — проанализировать нежелательные побочные реакции (НПР) при применении вакцин для профилактики новой коронавирусной инфекции (COVID-19), зарегистрированные в медицинских организациях Республики Татарстан в 2021 г.
В ГАУЗ «РКОД» МЗ РТ организован мониторинг безопасности лекарственных препаратов согласно приказу Росздравнадзора от 15.02.2017 № 1071 и приказу Министерства здравоохранения РТ от 14.07.2017 № 1535. В структуре диспансера имеется служба клинической фармакологии, функции которой включают сбор и анализ спонтанных сообщений о нежелательных побочных реакциях или неэффективности лекарственных препаратов. Цель исследования: проанализировать структуру нежелательных побочных реакций (НПР), зарегистрированных в РКОД в 2021 г.
Лекарственные препараты (ЛП), находящиеся в обращении в Российской Федерации, подлежат мониторингу эффективности и безопасности согласно статье 64 федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». Организацией, ответственной за анализ и систематизацию спонтанных сообщений об НПР, поступающих от медицинских организаций Республики Татарстан, является Казанский филиал ФГБУ «ИМЦЭУАОСМП» Росздравнадзора. Цель исследования: проанализировать структуру нежелательных побочных реакций (НПР), зарегистрированных в медицинских организациях Республики Татарстан в 2021 г.
Результаты ранее проведенного исследования (Волчегорский И. А., Важенин А. В., Алексеева А. П., 2022) позволяют рассматривать эмоксипин, этоксидол и мексидол в качестве равноэффективных средств поддерживающей терапии, улучшающих качество жизни на этапе послеоперационного лучевого лечения больных раком тела матки. В подобной ситуации решение вопроса о закупе медицинским учреждением оптимального лекарственного средства тесно связано с рыночной стоимостью лекарственного препарата и фармакоэкономическим показателем «затраты -ффективность», позволяющим выбрать лекарственное средство из группы анализируемых на основании минимальной стоимости «единицы эффекта». Цель: провести сравнительный анализ стоимости «единицы эффекта» эмоксипина, этоксидола и мексидола, применяемых для повышения качества жизни женщин, получающих лучевую терапию после хирургического лечения рака тела матки.
Цель исследования — анализ фармакотерапии пациентов старческого возраста в условиях отделения реанимации и интенсивной терапии (ОРИТ).
Благодаря реализации национальной программы «Борьба с онкологическими заболеваниями» ежегодно в России регистрируется и вносится в перечень ЖНЛВП ряд противоопухолевых лекарственных препаратов (ПЛП) преимущественно для проведения таргетной терапии и иммунотерапии [1]. Цель: изучить структуру нежелательных реакций (НР) при применении ПЛП на основе анализа спонтанных сообщений по Чувашской Республике за период с 01.09.2008 по 31.12.2021.
Цель исследования — провести анализ фармакоэкономической эффективности включения эмоксипина в схему стандартного лечения синдрома отмены алкоголя (СОА).
Цель исследования — раскрыть возможности персонализации фармакотерапии на основе фенотипирования; используя маркеры, проанализировать концентрации активных веществ в биологических жидкостях и на этой основе прогнозировать поведение других лекарственных средств в организме пациента, опираясь на фармакокинетику и данные о CYP; создание единого алгоритма выбора ЛС на основе полученных данных.
Авторы провели ретроспективный анализ эффективности и безопасности вирус-нейтрализующих моноклональных антител при лечении COVID-19.
В Российской Федерации численность женщин, находящихся в пери- и постменопаузе, составляет более 21 млн [1]. Помимо изменения уровня половых гормонов, связанных с менопаузой, ее сроки являются важным предиктором будущих исходов для здоровья, таких как длительность наличия вазомоторных симптомов и риск развития гормонально-зависимых опухолей. Ранее было широко исследовано влияние репродуктивных (например, возраст при менархе, беременности) и социально-демографических факторов на промежуточные и долгосрочные исходы менопаузы для здоровья. Однако влияние рациона женщины на течение менопаузы исследовано недостаточно. Также в литературе недостаточно данных о влиянии рациона в молодом возрасте, так называемых устоявшихся паттернов питания, на течение менопаузы. Авторы ставят цель изучить фактическое питание женщин менопаузального возраста, имеющих проявления климактерического синдрома, и предпринять попытку с помощью коррекции образа жизни, модификации рациона питания и применения минорных биологически активных веществ повлиять на качество жизни и проявление менопаузального синдрома; определить особенности структуры рациона женщин репродуктивного возраста (определить избыток и недостаток пищевых веществ) с целью создания алгоритма коррекции рациона и профилактики отсроченных факторов риска.
Цель работы — выявить клинико-фармакологические аспекты применения дидрогестерона в практике гинеколога.
Подагра с греческого переводится как «капкан для ноги», также это заболевание известно как «болезнь аристократов». Подагра знакома человечеству с древних времен, первые письменные упоминания подагры найдены в Древнем Египте, затем эта тема не раз поднималась в трудах таких столпов медицины, как Гиппократ, Цельс, Гален. И в современном мире данная проблема остается актуальной. Чаще всего этим недугом страдают мужчины старше 40 лет, однако в настоящее время отмечается увеличение заболеваемости подагрой, в том числе у женщин и лиц молодого возраста. Так что же такое подагра? Подагра — хроническое полиэтиологическое заболевание, связанное с нарушением пуринового обмена, характеризующееся повышением уровня мочевой кислоты в крови (гиперурикемия) и отложением натриевой соли мочевой кислоты (уратов) в суставах, околосуставных тканях и внутренних органах с развитием рецидивирующего артрита и образованием подагрических узелков (тофусов). Целью нашего исследования явилось изучение особенностей фармакотерапии подагры. Для ее достижения были поставлены и выполнены следующие задачи: рассмотрен механизм развития подагры как наследственного полиэтиологического заболевания, освещены биохимические аспекты формирования и течения заболевания. Лечение назначается в зависимости от периода заболевания, это препараты для купирования приступа (НПВС, колхицин, ГКС и моноклональные антитела) и поддерживающая терапия в межприступный период (аллопуринол и урикозурические препараты). В ходе работы нас заинтересовали механизмы действия таких препаратов, как аллопуринол и колхицин, поэтому им было уделено особое внимание.
В последние годы рациональное лечение бронхолегочных заболеваний у детей в современной педиатрии развивается по всем направлениям и имеет большое значение. Медицинская статистика в разных странах фиксирует неуклонный ежегодный прирост числа заболевших респираторными инфекциями, рецидивирующим бронхитом, бронхопневмонией. Одним из основных компонентов адекватного этиопатогенетического лечения бактериальных инфекций, вне зависимости от тяжести и локализации воспалительного процесса, является рациональный выбор антибактериальных средств. Актуальной проблемой была и остается безопасная фармакотерапия растущего организма с учетом этиологии и патогенеза заболеваний, соответственно стандарту лечения. Целью настоящего исследования явилась оценка эффективности препарата «Амоксициллин» в зависимости от тяжести течения, осложнении и сопутствующей патологии у детей, получающих стационарное лечение в клинике ТашПМИ.
Цель исследования — изучить анальгетическую активность синтезированных образцов новых производных цианотиоацетамида в классическом тесте горячей пластины (hotplate) на белых крысах.
Фонтурацетам (фенотропил) — лекарственное средство из группы ноотропов, производное пирацетама. По состоянию на 2022 г. входит в список ЖНВЛП. [1] Разрабатывался в 1980-х гг. в Институте медико-биологических проблем РАН для повышения физической и психической деятельности космонавтов. Промышленный метод синтеза был разработан на базе кафедры химии РНИМУ имени Н. И. Пирогова в 2006 г. [2]. Фонтурацетам обладает широким спектром фармакологических эффектов, проникает через ГЭБ, абсолютная биодоступность 100 %, Сmax в крови достигается через 1 ч, не метаболизируется в организме и выводится в неизмененном виде, T1/2 составляет 3–5 ч; может успешно применяться как нейроцитопротектор, противосудорожный, анксиолитический лекарственный препарат, в недавних исследованиях обнаружен слабый иммуномодуляторный эффект; обладает свойствами допингового средства [3]. Основные эффекты основаны на повышении регионарного кровотока в ишемизированных тканях, усиление метаболизма и утилизация глюкозы, а также повышении уровней норадреналина, дофамина и серотонина в ЦНС [4].
Несмотря на достигнутые успехи в противомикробной терапии, инфекционные заболевания все же остаются одной из ведущих причин смерти по всему миру. Отрицательные результаты лечения бактериальных инфекций в большинстве случаев связаны с появлением возбудителей, имеющих резистентность к применяемым антибактериальным средствам. Вся эта ситуация осложняется тем, что проблема резистентности штаммов к антибиотикам в настоящее время приобретает все более угрожающий характер. Темпы распространения резистентности сильно опережают возможности разработки новых антимикробных препаратов (АМП). Например, тревожными являются и сообщения об устойчивости к карбапенемам у штаммов Klebsiella pneumoniae и других видов энтеробактерий, а также стремительное распространение карбапенемаз среди неферментирующих грамотрицательных бактерий (НФГБ). Единственным из одобренных АМП, обладающим активностью против резистентных грамположительных и грамотрицательных возбудителей, является тигециклин — первый и единственный представитель нового класса антибиотиков — глицилциклинов. Тигециклин под торговым названием «Тигацил»® (компания Wyeth Pharmaceuticals Inc.) зарегистрирован в Российской Федерации в октябре 2009 г.