Оценка
эффективности и безопасности
профилактических и лекарственных
препаратов
Цель
занятия: освоение
основных подходов к оценке эффективности
и безопасности лекарственных и
профилактических препаратов. В
результате изучения темы студенты
должны знать:
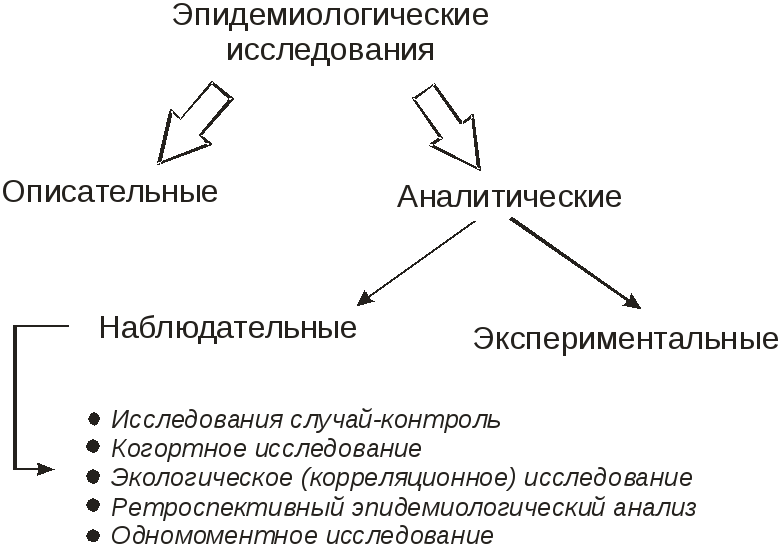
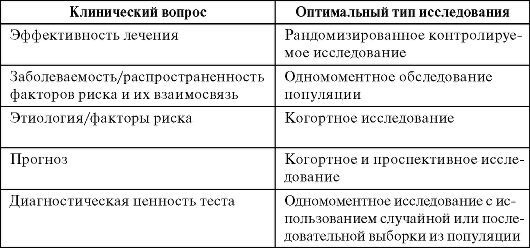
• определение
экспериментальных аналитических
эпидемиологических исследований,
их предназначение;
• определение
РКИ (рандомизированное клиническое
исследование);
• цели,
фазы, принципы организации РКП;
• случайные
и систематические ошибки РКИ;
• основные
стандарты проведения РКИ;
• основные
показатели оценки эффективности и
безопасности лекарственных и
профилактических препаратов.
В
результате изучения темы студенты
должны уметь:
• оценивать
правильность организации и проведения
РКИ;
• выявлять
источники ошибок проведенных РКИ;
• проводить
оценку статистической и клинической
значимости результатов РКИ.
САМОПОДГОТОВКА
К ЗАНЯТИЮ
Готовясь
к занятию, студенты самостоятельно
изучают рекомендованную литературу
и приведенный в главе информационный
материал.
Вопросы
для самоподготовки
1.
Определение РКИ.
2.
Цели РКИ.
3.
Фазы РКИ, их особенности.
4.
Случайные и систематические ошибки.
5.
Основные этапы, особенности и трудности
организации РКИ.
6.
Основные показатели для оценки результатов
исследования.
7.
Критерии оценки клинической значимости
результатов.
8.
Основные показатели для оценки побочных
эффектов вмешательства.
9.
Международные и Российские стандарты
организации РКИ.
10.
Принципы качественных клинических
испытаний.
11.
Основные документы для проведения РКИ.
12.
Этический аспект проведения РКИ.
Контроль
самоподготовки
Выполните
предложенные задания.
Задача
1. Пациенты с тяжелым хроническим зудом
участвовали в испытании лекарственных
средств (ЛС), купирующих зуд. В течение
каждой из трех недель в случайной
последовательности 48 пациентов получали
либо ципрогептадин, либо тримепразин,
либо плацебо. Кроме того, в графике
приема препаратов и плацебо был сделан
(также в случайном порядке) однонедельный
перерыв. Пациенты не знали? г какой
группе они принадлежат. Результаты
оценивали и представляли в баллах
выраженности зуда: чем выше балл, тем
сильнее зуд. Полученные средние значения
были следующими: ципрогептадин —
28
баллов, три-мепразина —
35
баллов, плацебо —
30
баллов, отсутствие лечения — 50 баллов.
• Сделайте
предварительный вывод об эффективности
каждого вмешательства.
• Укажите
причины, повлиявшие на результат.
Задача
2. Чтобы выяснить, предотвращает ли прием
пропранолола повторный инфаркт
миокарда, провели двойное слепое
рандомизированное испытание. После его
окончания, но до раскрытия кодов,
пациентов и медицинский персонал
попросили отгадать, какой препарат был
применен. Среди пациентов 79,9% правильно
отгадали пропранолол и 57,2% —
плацебо.
Врачи и медицинские сестры показали
аналогичный результат.
• Оцените,
каким образом данная ситуация может
повлиять на полученный результат.
ИНФОРМАЦИОННЫЙ
МАТЕРИАЛ
Значительные
успехи в выяснении причин возникновения
и распространения болезней послужили
основой разработки новых способов
их диагностики, лечения и профилактики,
многие из них обеспечили снижение
заболеваемости, прежде всего, инфекционной.
Все это способствовало укреплению
эмпирического подхода в медицине.
Особенность подхода — ориентация
на непосредственное изучение явлений.
В качестве методов используют реальное
наблюдение. Только такой подход, по
мнению большинства ученых, в значительной
степени гарантировал эффективность
применяемых способов диагностики,
лечения и профилактики болезней.
Преобладание в медицине эмпирического
подхода привело к тому, что практически
до середины XX в. суждение об эффективности
методов диагностики и способов лечения
больных было основано главным образом
наличном опыте, опыте данного коллектива
и мнении авторитета.
Вместе
с тем, еще в XV—XVI вв. некоторые ученые
полагали, что потенциальная
эффективность способов лечения и
профилактики болезней, хотя и
соответствующих эмпирическим
представлениям, должна быть обязательно
оценена в эксперименте. Эксперимент
(опыт)
— общенаучный метод проверки
причинно-следственных гипотез с помощью
контролируемого вмешательства в
естественное течение изучаемого явления.
Цель эпидемиологических экспериментальных
исследований — оценка потенциальной
и реальной эффективности и безопасности
профилактических и лекарственных
средств, способов и схем лечения,
диагностики и профилактики болезней.
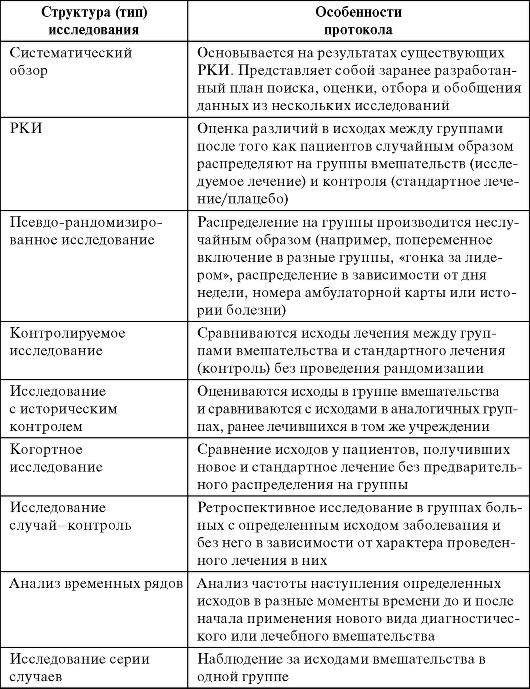
Классификация
экспериментальных эпидемиологических
исследований.
•
Рандомизированноеклиническоеисследование(РКИ):о1хенкап<утен1хпшьной
эффективности
и безопасности иммунобиологических
препаратов и ЛС.
• Рандомизированное
полевое исследование: оценка
потенциальной эффективности и
безопасности иммунобиологических
препаратов.
• Сплошное
полевое исследование: оценка
реальной эффективности и безопасности
иммунобиологических препаратов и ЛС.
До
появления на аптечных полках
фармацевтический продукт проходит
серьезные испытания. В мире принята
следующая практика: сначала эти испытания
проводят в рамках доклинической стадии
(preclinical
phase),
подразумевающей
разработку препарата в научных центрах
и лабораториях. Обычно организации,
разрабатывающие новые препараты,
называют организациями исследования
и развития (Research
and
Development).
В
крупных фармацевтических компаниях
существуют отделы исследований и
развития (Research
and
Development
Departments).
Однако
немало и мелких компаний, разрабатывающих
3—4 новых препарата или даже всего один
препарат. Часто финансирование таких
компаний обеспечено выпуском акций,
под которые мобилизуют средства для
проведения исследований. По завершении
доклинической фазы такие Research
and
Development
компании
могут продать свою формулу крупным
фармацевтическим фирмам или начать
проведение клинических исследований
(КИ) самостоятельно. Как правило, у них
нет ни опыта, ни возможности вести КИ,
тогда они начинают сотрудничество с
контрактными исследовательскими
организациями {Contract
Research
Organizations).
Стадии
разработки препарата
• Разработка
формулы (Development
of
a
Compound).
В
исследовательских лабораториях
разрабатывают концепцию нового продукта.
Характеристики продукта должны быть
направлены на положительное воздействие
на нежелательные патологические
состояния пациента или на замедление
/предотвращение их развития.
• Доклинические
испытания (Preclinical
Testing).
Для
того чтобы доказать отсутствие у
продукта каких-либо побочных эффектов
и его эффективность в заявленной
области медицины, проводят испытание
на животных (мышах, крысах, собаках и
обезьянах). Это доклинический этап
исследования. Цель этапа — доказать,
что продукт не обладает канцерогенным,
мутагенным, тератогенным действием.
Также доклиническое исследование
позволяет понять взаимодействие
продукта с организмом. Как только
фармацевтическая компания доказывает
безопасность продукта и возможную
эффективность в испытании на животных,
она передает эту информацию регулирующим
органам государства (в России это
Государственный фармакологический
комитет Минздрава РФ). Результат этого
обращения — официальное разрешение
на начало КИ.
• Клиническое
исследование (Clinical
Trials/Studies
in
Humans).
Его
проводят уже на людях. КИ лекарственного
средства — процесс длительный, он
может занять несколько лет. В каждую
последующую фазу вовлекают все больше
и больше испытуемых. Выделяют три фазы
исследования. Существует и четвертая,
постмаркетинговая (пострегистрационная),
фаза, когда за действием продукта
наблюдают уже после его выхода на
рынок лекарственных (профилактических)
средств. Чтобы обеспечить безопасность
и эффективность продукта,
компания-производитель обязана
анализировать результаты каждой
фазы.
Фазы
испытаний иммунобиологических препаратов
• /фаза.
Лабораторные
испытания вакцин — доклиническое
изучение на лабораторных животных
токсичности и безопасности, физических
свойств, химического состава препарата.
Изучение иммуногенности на лабораторных
животных. Определение концентрации
антигена.
•//
фаза. Ограниченные
исследования на иммуногенность и
безопасность. Определение правильной
концентрации антигена, числа компонентов
вакцины, техники изготовления, эффекта
последующих доз и основных побочных
реакций. Окончательный выбор типа
вакцины для проведения третьей фазы
(РКИ). Исследование проводят только
после положительного заключения
этического комитета, национального
органа контроля медико-биологических
препаратов на добровольцах.
•III
фаза. Широкомасштабные
испытания вакцин на здоровых пациентах
(тысячи добровольцев). Определение
эффективности вакцины и побочных
реакций; длительности наблюдения (обычно
1—2 года, но не менее 6 мес). Измерение
эффективности, установление частоты и
типов побочных реакций (рандомизированное
полевое исследование).
• VIфаза.
Постлицензионный
контроль качества вакцин. Продолжение
исследования частоты и силы побочных
реакций, реальной эффективности в
полевом опыте (сплошное полевое
исследование).
Фазы
клинических испытаний лекарственных
средств
• 1фаза.
Новый
продукт впервые испытывают на людях.
Цели этой фазы исследования связаны с
безопасностью продукта. Обычно привлекают
от 20 до 100 здоровых волонтеров (добровольцев)
и госпитализируют в специальный
центр. Если испытание на здоровых
добровольцах невозможно (ЛС для
лечения онкологических заболеваний,
СПИДа и др.) или бессмысленно, то можно
получить разрешение на проведение
первой фазы исследования на пациентах
с определенным патологическим
состоянием. Как правило, здоровые
волонтеры получают вознаграждение.
Чаще всего добровольцы — мужчины и
женщины 25—30 лет (женщины не беременные
и не кормящие); если препарат рассчитан
на применение в педиатрии, то на более
поздних стадиях могут участвовать
дети (нерандомизированное КИ). //
фаза. Оценивают
эффективность и безопасность препарата
у пациентов с заболеванием, для
лечения которого он и был разработан.
Часто это плацебо-контролируемые
исследования. Иногда эту фазу КИ разделяют
еще на две фазы. Цель первой из них —
оценка краткосрочной безопасности ЛС.
Второй — доказательство клини-
ческой
эффективности ЛС и определение
терапевтического уровня дозирования
при испытании на группе пациентов. Число
пациентов на этом этапе варьирует от
40 до 300 и зависит от размера ожидаемого
эффекта. Если планируемый эффект
значителен, достаточно небольшого числа
пациентов, чтобы доказать статистическую
значимость эксперимента. С другой
стороны, если эффект выражен в
недостаточной степени, пациентов
необходимо гораздо больше (рандомизированное
или нерандомизированное КИ).
•///
фаза. Л
С испытывают на больших группах пациентов
(сотни человек) разного возраста, с
различной сопутствующей патологией, в
многочисленных научно-исследовательских
центрах различных стран. Исследования
этой фазы часто бывают рандомизированными
контролируемыми. В них изучают все
аспекты лечения, включая оценку показателя
«риск/польза». На основании результатов
КИ Государственный фармакологический
комитет Минздрава РФ принимает решение
о регистрации или отказе в регистрации
ЛС (РКИ).
• VI
фаза. Наступает
после того, как Л С получил разрешение
к применению. Эту фазу часто называют
постмаркетинговой (пострегистрационной).
Цель исследований — выявление отличий
нового ЛС от других препаратов в
данной фармакологической группе,
сравнение его эффективности с аналогами,
уже реализуемыми на рынке, демонстрация
пользы сточки зрения экономики
здравоохранения, а также выявление и
определение ранее неизвестных или
неправильно определенных побочных
эффектов и факторов риска. В результате
безопасность и эффективность ЛС
могут быть периодически пересмотрены
в соответствии с новыми клиническими
данными по его применению
(сплошное/рандомизированное
клиническое/полевое исследование).
Критерии
включения и исключения
• Критерии
включения пациентов
(обследуемых). Необходимы для описания
популяции (генеральной совокупности),
которой соответствуют включенные в
исследование пациенты.
• Критерии
исключения. Необходимы
для создания однородной выборки,
т.е. меньшей вариабельности переменных
в исходном состоянии и в оценке
величины эффекта вмешательства. Из
числа участников КИ исключаютлица
с тяжелыми сопутствующими болезнями,
состоянием, угрожающим жизни или мешающим
выполнять условия эксперимента (например,
с деменцией). Таким образом статистическая
чувствительность эксперимента растет.
Согласие
участников
В
идеале все пациенты, подходящие под
критерии включения, должны участвовать
в испытании. На практике же не все
пациенты дают согласие. Одни могут
предпочесть какой-либо из испытываемых
методов лечения и не желают предоставлять
его выбор случаю. Другие в принципе
не хотят быть объектом исследования
или избирают иной способ лечения. Таких
пациентов в исследование не включают.
Необходимо, чтобы отклик (response
rate),
т.е.
доля людей, откликнувшихся на просьбу
участвовать в исследовании, был достаточно
высок, не менее 80%. Пациенты будут
следовать рекомендациям в зависимости
от приемлемости исследования.
Результаты лечения таких пациентов
выше и не зависимы от лечения.
Испытуемые, активно выбирающие некоторый
метод лечения, лечатся старательнее,
правильнее выполняют назначения. Это
свойство людей называют аккуратностью
или исполнительностью, но чаще —
комплайенс.
Планирование
количества участников
Количество
включенных в эксперимент пациентов
(размер выборки) должно быть обосновано,
при этом исходят из:
• предполагаемого
уровня эффективности;
• структуры
исследования;
• заранее
установленного порога статистической
значимости обнаружения эффекта.
• распространенности
заболевания.
При
планировании исследования рассчитывают,
чтобы количество пациентов было
достаточным для обнаружения предполагаемого
эффекта. Вычисления довольно сложны,
их выполняют с помощью статистических
программ.
Рандомизация
—
случайное
распределение пациентов по группам. Ее
цель — минимальные различия между
группами, по всем признакам носящим
случайный, а не преднамеренный характер.
Из принципа случайного комплектования
групп исходит методология статистического
анализа данных: различия групп по
определению случайны.
Рандомизацию
проводят разными способами: использование
таблиц случайных чисел, компьютерных
программ. Иногда рандомизацию подменяют
псевдорандомизацией (распределение в
группы по первой букве имени, дате
рождения, номеру медицинской карты, дню
недели поступления в клинику и т.д.).
Ее применение может повлиять на
правильность формирования выборки и,
соответственно, на оценку результатов.
Самое
неблагоприятное
следствие псевдорандомизации — будет
известна принадлежность каждого
пациента к конкретной группе (основной
или контрольной). Таким образом, не
будет выполнено главное условие
рандомизации — сокрытие ее результатов;
не будет реализована важнейшая ее
функция — обеспечение слепого характера
исследования. В исследованиях, где
не были приняты меры по сокрытию
результатов рандомизации или сокрытие
было недостаточным, оценка эффективности
вмешательства оказалась завышена
примерно на 25 %. Для обеспечения сокрытия
принимают надежные технические меры
(например, после регистрации пациента,
давшего согласие на испытание, информацию
о нем заносят в БД организатора
исследования).
Плацебо
При
оценке эффективности нового препарата
возникает вопрос о его действенности,
т. е. способности уменьшить вероятность
развития неблагоприятных исходов
по сравнению с отсутствием вмешательства.
В контрольной группе отсутствие
вмешательства может быть психологически
неприемлемо для пациентов, приводя к
неисполнению ими режима испытания.
Больные, оставшиеся без лечения, переходят
на самолечение. Именно поэтому пациентам
контрольной группы дают вещество
(проводят процедуры), неотличимое от
активного вмешательства. Обычно плацебо
— это лекарственная форма, лишенная
активного компонента, например
таблетированная форма, идентичная
активной по цвету, форме, но содержащая
только индифферентное вещество —
каолин, крахмал, для инъекционных форм
— изотонический раствор хлорида натрия.
Применение плацебо не всегда возможно,
а иногда и неэтично, например, когда
больных недопустимо лишать эффективного
лечения. Тогда контрольной группе
назначают стандартное лечение и плацебо,
а основной группе — стандартное лечение
и исследуемый препарат. Действенность
нового ЛС легче показать в сравнении с
плацебо, при сравнении с уже существующим
ЛС надо доказать больший или такой же
эффект нового препарата.
Полагают,
что применение плацебо дает положительный
эффект, «эффект плацебо». Благоприятный
эффект плацебо связан с его психологическим
действием на больного. Плацебо оказывает
незначительное влияние только на исходы,
отражающие субъективное состояние
больного (качество сна, интенсивность
боли). На клинически важные исходы прием
плацебо не влияет (продолжительность
жизни, длительность ремиссии,
функциональный дефект и т.д.).
Слепой
метод
Главное
условие правильности организации
испытания — «ослепление» участников,
т. е. сокрытие принадлежности каждого
из них к контрольной или основной
группе. Это необходимо для предотвращения
систематических ошибок. Иногда вместо
«ослепление» применяют термин
«маскирование».
• «Слепое
испытание» — если лечение известно
исследователю, но неизвестно пациенту.
• «Двойное
слепое испытание» — если о принадлежности
каждого пациента к конкретной группе
не известно ни пациенту, ни исследователю.
• «Тройные
слепые испытания» — если результат
рандомизации скрыт не только от пациента
и исследователя, но и от статистика,
анализирующего данные.
• «Четверное
испытание» — если привлекают второго
исследователя для оценки эффективности
ЛС у пациентов при сокрытии от него
результатов рандомизации.
• Открытые
РКИ — если результат рандомизации не
скрывают.
Особенности
организации и проведения экспериментальных
исследований
Неконтролируемый
эксперимент
Неконтролируемый
эксперимент в виде наблюдения за
результатами вмешательства — самый
простой вид эксперимента. Он дает
достаточные основания для оценки
вмешательства только если размер эффекта
огромен. Так, хинин при малярии и
нитроглицерин при стенокардии
демонстрируют замечательный эффект,
не требующий дальнейшей проверки. За
редкими исключениями медицинские
вмешательства незначительно влияют на
исход болезни. Поэтому эффект легко не
заметить, если проводить неконтролируемый
эксперимент и так же легко обнаружить
эффект там, где его нет.
Испытание
в параллельных группах
Простейший
случай КИ — сравнение результатов
вмешательства в двух группах, контрольной
и основной. Пациенты основной группы
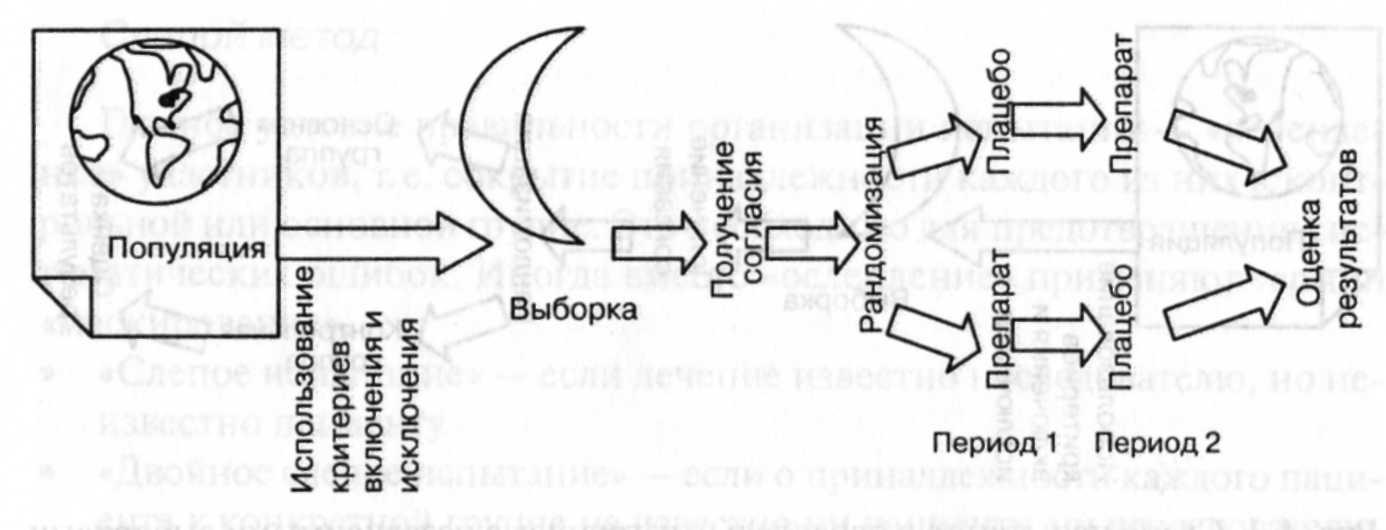
получают исследуемый препарат, а
контрольной — плацебо (рис. 4-1). Такую
методику обозначают как проспективное
исследование с вмешательством и с
параллельным контролем.
Рис.
4-1. Схема
испытания в параллельных группах с
независимыми выборками
Это
схема испытания (рис. 4-2), при которой
каждому пациенту в одной группе
соответствует парный пациент в другой.
Парой может быть пациент, подобранный,
к примеру, по полу и равному возрасту.
После подбора пары проводят рандомизацию:
один пациент из пары получает изучаемое
лечение, второй — плацебо.
Рис.
4-2. Схема
испытания в параллельных группах с
подбором пар
Перекрестное
испытание
Чтобы
максимально устранить неизбежную
межиндивидуальную вариабельность,
применяют перекрестную организацию
(рис. 4-3). При этом между основной и
контрольной группами почти нет отличий:
обе группы по очереди получают изучаемый
препарат и плацебо (или референц
препарат). Таким образом, обе группы
одновременно основные и контрольные.
Главное достоинство такой схемы —
экономичность. Статистически значимый
результат можно получить при числе
пациентов в 2 раза меньшем, чем при
параллельном контроле.
Рис.
4-3. Проведение исследования по схеме
«перекрестное испытание» Факторная
структура эксперимента
В
случае факторной структуры эксперимента
можно сравнить более двух вмешательств
на одной группе пациентов (табл. 4-1). Для
этого сначала рандомизируют пациентов
для препарата 1 и плацебо, а затем — для
препарата 2 и плацебо. Как результат:
• пациенты,
получающие препарат А и В;
• пациенты,
получающие препарат В и плацебо;
• пациенты,
получающие препарат А и плацебо;
• пациенты,
получающие только плацебо.
Такая
структура эксперимента экономически
выгодна по сравнению с проведением двух
самостоятельных испытаний. Таблица
4-1. Пример факторной структуры эксперимента
Трудности
назначения препарата
Независимо
от характера вмешательства (лечебное,
диагностическое, профилактическое)
оно должно быть ясно описано и
стандартизировано.
При
назначении некоторых вмешательств
подбор дозы не вызывает трудностей:
парентеральное введение препарата по
схеме обеспечивает поступление в
организм известного количества активного
вещества. Применение пероральных
форм препаратов уже приводит к трудностям
в дозировке. В зависимости от
комплайенса пациенты могут не принять
суточную дозу, а в случае выраженных
побочных эффектов — и вовсе ее уменьшить.
Есть вмешательства, дозировать которые
трудно. К ним относят оперативные
вмешательства, мануальную терапию,
иглорефлексотерапию.
В
ходе КИ обычно прекращают лечение, ранее
назначенное пациенту. Срок после
прекращения прошлого лечения и до начала
КИ устанавливают таким образом, чтобы
упала концентрация активного вещества.
Если пациенты основной группы принимают
дополнительные препараты (коинтервенция),
то может возникнуть смещение результатов
в сторону более высокой эффективности.
Если пациенты контрольной группы
используют те же препараты, что и в
основной группе (контаминация,
загрязнение), то результат может быть
сдвинут в сторону неэффективности
препарата.
В
испытании принимают меры по предотвращению
контаминации и коинтервенции и по
повышению комплайенса пациентов и
персонала в выполнении предписанных
протоколом действий. Один из способов
— проведение вводного этапа до испытания.
На этом этапе не соблюдающих режим
пациентов выявляют, например, путем
определения в моче веществ, введенных
в препарат в качестве метки. Затем в
испытание включают только исполнительных
пациентов. Коинтервенция и контаминация
почти неизбежны, их необходимо учитывать
при анализе данных.
Исходы
(«целевые» признаки) — события, по
которым будут оценивать эффективность
лечения или других вмешательств. Виды
исходов:
• клинически
важные исходы (летальность, продолжительность
жизни, частота обострений, сохранение
работоспособности);
• промежуточные;
• косвенные;
• суррогатные
исходы.
Качество
жизни
При
оценке эффективности вмешательства не
следует забывать об оценке качества
жизни. Иногда небольшого увеличения
продолжительности жизни можно достичь
неприемлемыми страданиями в процессе
лечения, например, в онкологии. Для
оценки качества жизни применяют сложные
шкалы, итоговую оценку на которых
получают в результате суммирования
разнообразных сведений (об интенсивности
боли, настроении, состоянии дыхания,
способности мыться самостоятельно,
обслуживать себя).
Прекращение
испытания
Длительность
КИ планируют исходя из количества
участников, ожидаемой частоты исходов
и различия между вмешательствами
(размера эффекта), из планируемой
статистической значимости результата.
Проводить испытания до того момента,
когда его результат станет статистически
значимым, неправильно, поскольку рано
или поздно можно достичь статистически
значимые различия. Именно поэтому
длительность КИ устанавливают заранее.
В
длительных испытаниях правила прекращения
КИ устанавливают в связи с необходимостью
обеспечения безопасности участников
и с возможным получением убедительных
результатов в пользу одного из изучаемых
вмешательств.
Испытания
с анализом данных в зависимости от
назначенного или полученного лечения
Результаты
контролируемых рандомизированных
испытаний можно анализировать и
представлять двумя способами: либо на
основании факта назначения того или
иного лечения при рандомизации, либо
на основании лечения, полученного
пациентом фактически. Правильное
представление результатов зависит
от постановки вопроса.
• Если
вопрос в том, какая тактика лечения
более предпочтительна для принятия
клинического решения, то следует
применять анализ, исходящий из лечения,
назначенного при рандомизации, независимо
оттого, всели пациенты на самом деле
получали это лечение. Этот подход
называют анализом в зависимости от
назначенного лечения (intention
to
treat
analysis).
Достоинства
такого подхода: поставленный вопрос
соответствует тому, который обычно
интересует клинициста при назначении
лечения, а сравниваемые пациенты
действительно распределены по группам
случайным образом. Недостаток: если
многие пациенты не получали
предписанного лечения, то различия
между экспериментальной и контрольной
группами исчезают, вероятность
отрицательного результата исследования
растет. В таком случае отсутствие
различия между группами может быть
трактовано по-разному: то ли
экспериментальное вмешательство на
самом деле неэффективно, то ли оно
просто не было применено.
• Если
нас интересует, действительно ли
экспериментальное лечение лучше
контрольного. В этом случае для ответа
больше подходит анализ, исходящий
из полученного лечения, т.е. оценка
эффекта того лечения, которое каждый
больной получал в действительности и
вне
зависимости
от того, какое лечение ему было назначено
при рандомизации. При этом выясняют
механизм изучаемого эффекта. Недостаток
этого подхода: если большинство пациентов
не получали предписанного лечения,
испытание перестает быть рандомизированным
и становится обычным когортным
исследованием. Это значит, что все
различия между группами, исключая способ
лечения, должны быть каким-то образом
нивелированы (путем введения ограничений,
подбора пар, разделения на подгруппы
или стандартизации) для достижения
полной сопоставимости, как это происходит
при неэкспериментальных исследованиях.
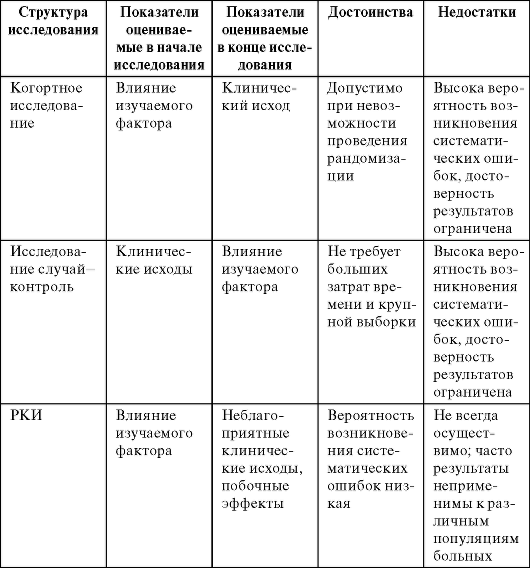
Статистическая
оценка результатов испытания Таблица
4-2. Таблица для расчета показателей
эффективности
Организации,
отвечающие за проверку результатов
клинических испытаний
В
большинстве стран мира открыты специальные
отделы, относящиеся к министерству
здравоохранения или другим департаментам,
отвечающие за проверку результатов
КИ, проводимых по новым препаратам, и
за выдачу разрешений на поступление
медицинского продукта (препарата,
аппарата) в сеть аптек.
Например,
в
Соединенных
Штатах,
это
— Food
and Drug Administration (FDA) в
составе
Department
of Health & Human Services. Это
учреждение действует в соответствии
со статьей 21 кодекса федеральных законов
21
Code
of
Federal
Regulations.
В
России в составе Минздрава РФ есть
отдел, действующий на основании
приказа № 266 «Об утверждении Правил
клинической практики в РФ» от 19 июля
2003 г.
Международные
требования
Основа
проведения КИ — документ международной
организации «Международной Конференции
по Гармонизации» (ICH).
Этот документ называют «Guidelinefor
Good
Clinical
Practice
(GCP)»
(«Описание
стандарта GCP>,
GCPчасто
переводят как «Надлежащая (качественная)
клиническая практика»).
Кроме
врачей, в области КИ работают и другие
специалисты по КИ.
КИ
необходимо проводить в соответствии с
основополагающими этическими принципами
Хельсинкской Декларации, стандарта GCP
и
действующими нормативными требованиями.
До начала КИ необходимо оценивать
соотношения предвидимого риска с
ожидаемой пользой для испытуемого и
общества. Во главе угла — принцип
приоритета прав, безопасности и здоровья
испытуемого над интересами науки и
общества. Испытуемый может быть включен
в исследование только на основании
добровольного информированного согласия,
полученного после детального
ознакомления с материалами исследования.
Это согласие заверяют подписью пациента
(волонтера).
КИ
должно быть научно обосновано, подробно
и ясно описано в протоколе исследования.
Оценка соотношения рисков и пользы, а
также рассмотрение и одобрение протокола
исследования и другой документации,
связанной с проведением КИ, входят в
обязанности Экспертного совета
организации/Независимого этического
комитета (ЭСО/НЭК). После получения
одобрения от ЭСО/НЭК можно приступать
к проведению КИ.
Разработка
Л С и их КИ — процедуры очень дорогие.
Некоторые фирмы, стремясь снизить
стоимость испытаний, проводят их вначале
в странах, где требования и стоимость
значительно ниже, чем в стране
фирмы-разработчика. Так, многие
вакцины первоначально были испытаны в
Индии, Китае и других странах третьего
мира. В качестве 2—3 этапа КИ использовали
и благотворительные поставки вакцин
в страны Африки и Юго-Восточной Азии.
Принципы
качественных клинических испытаний
В
РФ Приказом Федерального агентства по
техническому регулированию и
метрологии от 27 сентября 2005 г. № 232-ст
утвержден Национальный стандарт РФ
(см. Приложение 1). Настоящий стандарт
идентичен Руководству по надлежащей
клинической практике {Consolidated
GCP)
Международной
конференции по гармонизации технических
требований к регистрации фармацевтических
продуктов, предназначенных для применения
человеком (International
Conference
on
Harmonization
of
Technical
Requirements
for
Registration
of
Pharmaceuticals
for
Human
Use;
ICH).
Он
подготовлен Ассоциацией международных
фармацевтических производителей,
Международной конфедерацией обществ
потребителей (КонфОП), РАМН. Надлежащая
клиническая практика: международный
этический и научный стандарт планирования
и проведения исследований с участием
человека в качестве субъекта, а также
документального оформления и представления
результатов таких исследований.
Соблюдение
указанного стандарта служит для общества
гарантией того, что права, безопасность
и благополучие субъектов исследования
защищены, согласованы с принципами,
заложенными Хельсинкской декларацией
(см. Приложение 2) Всемирной медицинской
ассоциации, и что данные КИ достоверны.
Цель
настоящего национального стандарта —
установление единых со странами
Европейского Союза, США и Японией правил,
способствующих взаимному признанию
данных КИ уполномоченными органами
названных стран.
Принципы
качественных КИ (GCP).
• КИ
необходимо проводить в соответствии с
основополагающими этическими принципами
Хельсинской декларации, Правилами GCP
и
действующими нормативными требованиями.
• До
начала КИ должна быть проведена оценка
соотношения предвидимого риска с
ожидаемой пользой для испытуемого и
общества. КИ может быть начато и продолжено
только в случае преобладания ожидаемой
пользы над риском.
• Права,
безопасность и здоровье испытуемого
важнее интересов науки и общества.
• Обоснованием
планируемого КИ должны служить данные
доклинического и клинического
изучения исследуемого препарата.
• КИ
должно быть научно обосновано, подробно
и ясно описано в протоколе исследования.
• КИ
проводят в соответствии с протоколом,
заблаговременно утвержденным/одобренным
Экспертным Советом/Комитетом по этике.
• Ответственность
за оказание медицинской помощи испытуемому
может взять только квалифицированный
врач.
• Вселица,
участвующие в проведении КИ, должны
получить профессиональное образование
и опыт, соответствующий поставленным
задачам.
• Испытуемый
может быть включен в испытание только
на основании добровольного информированного
согласия, полученного после детального
ознакомления с материалами исследования.
• Сбор,
обработка и хранение информации,
полученной входе КИ, должны обеспечивать
точное и правильное представление,
объяснение и подтверждение данных.
• Документы,
позволяющие установить личность
испытуемого, необходимо сохранять
в тайне от неуполномоченных лиц.
• Производство
и хранение исследуемого препарата, а
также обращение с ним осуществляют
в соответствии с Правилами организации
производства и контроля качества ЛС,
или Good
Manufacturing
Practice
(GMP).
Препарат
используют в соответствии с утвержденным
протоколом исследования.
Документы,
необходимые для проведения рандомизированного
клинического испытания
• Протокол
исследования и поправки к нему.
• Форма
письменного информированного согласия,
ее последующие редакции.
• Материалы
для привлечения испытуемых в исследование
(например, рекламные объявления).
• Брошюра
исследователя.
• Информация
по безопасности исследуемого препарата.
• Информация
о выплатах и компенсациях испытуемым.
• Curriculum
vitae
исследователя на настоящий момент и/или
другие материалы, подтверждающие
его квалификацию.
• Любые
другие документы, которые могут быть
необходимы Экспертному совету/Комитету
по этике для исполнения своих обязанностей.
Экспертный
совет/Комитет по этике
Согласно
Указу Минздрава РФ от 19 августа 1999 г. №
891-У функции Комитета по этике при
Федеральном органе контроля качества,
эффективности и безопасности Л С
возложены на Национальный этический
комитет.
Основная
задача Экспертного совета/Комитета по
этике — защита прав и здоровья испытуемых,
а также гарантия их безопасности. Особое
внимание уделено исследованиям,
участниками которых могут стать уязвимые
испытуемые. Экспертный совет/Комитет
по этике получает на рассмотрение
документы, указанные выше (документы,
необходимые для проведения РКИ).
Экспертный
совет/Комитет по этике рассматривает
вопрос о проведении КИ в установленные
сроки и дает письменное заключение,
указывая название исследования,
рассмотренные документы и дату одного
из следующих возможных решений:
• разрешения/одобрения
на проведение исследования;
• требования
о внесении изменений в предоставленную
документацию для получения
разрешения/одобрения на проведение
испытания;
• отказа
в разрешении/одобрении на проведение
исследования;
• отмены/приостановления
данных ранее разрешения/одобрения на
проведение исследования.
Экспертный
совет/Комитет по этике оценивает
квалификацию исследователя на
основании его curriculum
vitae
на
настоящий момент и/или другой необходимой
документации, полученной по запросу
Экспертного совета/Комитета по этике.
В
процессе исследования Экспертный
совет/Комитет по этике рассматривает
документацию с частотой, зависящей от
степени риска испытуемых, но не реже
одного раза в год.
Если
протокол указывает на невозможность
получения согласия испытуемого или
его законного представителя до момента
включения в исследование (например,
при терапии неотложных состояний),
Экспертный совет/Комитет по этике должен
убедиться в том, что в предоставленном
протоколе и/или другой документации
полноценно отражены этические аспекты
этого исследования.
Во
избежание необоснованной заинтересованности
или принуждения испытуемых Экспертный
совет/Комитет по этике рассматривает
порядок и суммы выплат испытуемым.
В
состав Экспертного совета/Комитета по
этике должно входить достаточное
количество лиц, обладающих необходимым
опытом и квалификацией для экспертной
оценки научных, медицинских и этических
аспектов планируемого исследования.
В
состав Экспертного совета/Комитета по
этике рекомендовано включение:
• не
менее пяти членов; среди них:
• одного
члена и более не научного работника;
• одного
члена и более не сотрудника медицинского
учреждения/исследовательского
центра, в котором проводят испытание.
Только
члены Экспертного совета/Комитета по
этике, не являющиеся сотрудниками
исследователя или спонсора, могут
участвовать в голосовании по вопросу
разрешения/одобрения исследования.
Эксперт-
ный
совет/Комитет по этике оформляет список
своих членов с указанием их квалификации.
Экспертный совет/Комитет по этике
действует в соответствии с утвержденными
стандартными процедурами, ведет
необходимую документацию и протоколирует
заседания. Его деятельность должна
соответствовать Правилам ССР и действующим
нормативным требованиям. На официальных
заседаниях Экспертный совет/Комитет
по этике принимает решения при наличии
кворума, определенного соответствующим
положением. Только члены Экспертного
Совета/Комитета по этике, непосредственно
участвующие в рассмотрении документации
по исследованию и его обсуждении,
могут голосовать и давать рекомендации
по вопросу разрешения/одобрения
испытания. Исследователь предоставляет
информацию Экспертному совету/Комитету
по этике по любым аспектам исследования,
однако не участвует в прениях или в
голосовании по вопросу разрешения/одобрения
испытания.
Информированное
согласие
Доктрина
информированного согласия (см. Приложение
2 п. 4.8 и Приложение 3) означает, что врач,
прежде чем попросить у пациента согласие
на проведение курса лечения или отдельной
процедуры, связанных с риском и
имеющих альтернативы (особенно если
шансы достичь успеха невысоки), должен
предоставить пациенту следующую
информацию:
• суть
предлагаемого лечения (процедуры);
• риски
и выгоды рекомендуемых мер, степень
опасности самых неблагоприятных
исходов (гибели или тяжелой инвалидности);
• альтернативные
методы лечения (процедуры), риски,
опасность неблагоприятных исходов;
• последствия
отложенного или не начатого лечения;
• вероятность
успешного исхода, проявление этого
успеха;
• вероятные
трудности и длительность периода
реабилитации и возврата пациента к
нормальному для него объему деятельности;
• прочие
сопутствующие сведения в форме ответов
на вопросы, изложение аналогичных
случаев из своего опыта, опыта бригады
и т. п. Информация должна быть предоставлена
в доступной для пациента
форме,
на понятном для него языке. Вопрос о
компетентности решения часто возникает
при заведомой неправоспособности
пациента (дети, лица, признанные
недееспособными в силу психических
нарушений, дебильности, старческого
слабоумия и т.д.). Здесь решения принимают
по тем же схемам, с участием опекунов
или попечителей. Относительно
бездомных
людей решения принимают социальные
работники, специально на это
уполномоченные. Если в семье или в
органах опеки нет единого мнения, то
вопрос о единственном опекуне решает
суд. Добровольность — отсутствие
какого-либо внешнего давления (угроза,
подкуп, кабальные финансовые условия)
на пациента при принятии решения,
особенно при подписании письменных
согласий или отказов.
Эталоны
ответов к заданиям для самоподготовки
К
задаче 1. Различные ЛС могут обладать
специфическим действием (например,
антибактериальные препараты), смешанным
действием (например, наркотические
препараты) и неспецифическим действием
(например, противозудные препараты).
При этом препараты с неспецифическим
действием оказывают влияние за счет
психологического эффекта. Также следует
обратить внимание на «эффект плацебо».
Оба
активных препарата и плацебо давали
примерно одинаковое снижение
выраженности зуда в отличие от отсутствия
вмешательства.
Причина
эффективности плацебо — «эффект
плацебо», причина эффективности
препаратов — неспецифическое действие
противозудных препаратов.
К
задаче 2. Пациенты и медицинский персонал
могли отгадать принадлежность
испытуемого к контрольной или основной
группе по уре-жению частоты сердечных
сокращений.
Пациенты
контрольной группы, узнав, что они
получают плацебо, могут начать прием
активного препарата, таким образом,
возможно смещение результата в сторону
занижения эффективности испытуемого
препарата.
РАБОТА
НА ЗАНЯТИИ
Вопросы
для отработки на практическом занятии
1.
РКИ — «золотой» стандарт экспериментальных
исследований по оценке потенциальной
эффективности лечебных и профилактических
препаратов (Задачи № 1—9).
2.
Цели РКИ. Оценка безопасности и
эффективности (действенность и собственно
эффективность). Внутренняя и внешняя
достоверность РКИ (Задачи № 1-9).
3.
Фазы РКИ.
4.
Случайные и систематические ошибки
(Задачи № 1—9).
5.
Организация РКИ:
о
Планирование
числа участников.
о
Критерии
включения/исключения. Согласие участников.
Комп-
лайенс.
о
Формирование
выборки.
о
Рандомизация:
цели, методы, ошибки. Псевдорандомизация
(Задача 1).
о
Плацебо:
цели применения плацебо (Задача 6).
о
Ослепление
(маскирование) исследования: слепое,
двойное тройное и четверное слепое
испытание (Задачи 2, 3, 5).
о
Распределение
и применение вмешательств. Испытания
в параллельных группах (независимые
и связанные выборки), перекрестное
испытание, факторная структура
эксперимента, исторический и внешний
контроль.
о
Трудности
назначения препарата (Задача 7).
о
Исходы
исследования: методы оценки. Клинически
важные исходы, промежуточные,
косвенные, суррогатные исходы. Качество
жизни (Задача 4).
о
Прекращение
испытания: планирование длительности
эксперимента.
6.
Статистическая и клиническая значимость
результатов. Показатели величины
эффекта. Оценка клинической значимости
(Задачи 8, 9).
7.
Изучение побочных эффектов вмешательства.
8.
Стандарт отрасли ОСТ 42-511-99 «Правила
проведения качественных КИ в Российской
Федерации». Область применения.
9.
Принципы качественных КИ (GCP).
10.
Основные документы, необходимые для
проведения исследования.
11.
Этические аспекты проведения РКИ.
Указанные
вопросы отрабатывают при решении
ситуационных задач.
Ситуационные
задачи
Задача
1.
При проведении КИ двух ЛС пациентов
делили на группы разными способами. В
первом случае пациентов делили по
четности номера карты (четные номера
— основная группа, нечетные —
контрольная). Во втором случае — по
дню недели поступления в стационар
(понедельник, среда, пятница, воскресенье
— основная группа, вторник, четверг,
суббота — контрольная).
• Оцените
правильность организации первого и
второго исследования.
• Дайте
рекомендации по проведению рандомизации.
Задача
2.
1)
В КИ нового препарата для снижения
уровня триглицеридов крови пациенты
были поделены на две группы. Пациенты
первой группы получали препарат, второй
группы — плацебо. Пациенты знали свою
принадлежность к группе.
2)
В КИ антибиотика у пациентов с пневмонией
результат оценивали по изменению
рентгенологической картины. Врач,
проводивший испытание, знал
принадлежность пациентов к контрольной
или основной группе. При этом улучшение
рентгенологической картины врач быстрее
выявлял у пациентов экспериментальной
группы.
3)
Было проведено КИ нового дорогостоящего
препарата класса статинов. Статистик,
оценивающий результаты, знал принадлежность
пациентов к контрольной или основной
группе. По совместительству статистик
работал в фармацевтической компании,
заказавшей это исследование.
• Оцените
правильность организации исследований
в указанных случаях.
• Объясните,
каким образом такая организация
исследования могла повлиять на
полученные результаты.
Задача
3.
В исследовании первичной профилактики
сердечно-сосудистых заболеваний
было использовано практически идеальное
плацебо. Одни участники получали
колестирамин (экспериментальная группа),
другие — плацебо (контрольная группа).
Однако побочные эффекты были отмечены
существенно чаще в экспериментальной
группе. В конце первого года испытания
у пациентов экспериментальной группы
чаще, чем контрольной, были запоры
(39% против 10%), изжога (27% против 10%), отрыжка
и метеоризм (27% против 16%), а также тошнота
(16% против 8%).
• Оцените,
каким образом данная ситуация может
повлиять на полученные результаты.
Задача
4.
В крупном исследовании изучали влияния
нескольких ги-полипидемических препаратов
на развитие стенокардии 1103 мужчинам
был назначен клофибрат и 2789 мужчинам —
плацебо. Летальность за последние 5 лет
составила в среднем 20,0% в группе
принимавших клофибрат и 20,9% в группе
принимавших плацебо, что указывает на
неэффективность препарата. В то же время
было обнаружено, что не все пациенты
принимали ЛС. Был ли клофибрат эффективен
утех, кто действительно принимал
препарат? Ответ был утвердительным. В
экспериментальной группе летальность
за последние 5 лет среди пациентов,
действительно принимавших клофибрат,
составила 11,0 % по сравнению
с
26,4% у пациентов, не соблюдавших схему
лечения (р< 0,05). Летальность среди
больных, строго выполнявших назначения
и принимавших плацебо, также снизилась.
В данном случае летальность за последние
5 лет у пациентов, действительно
принимавших препарат, составила 19,3%
против 25,3% среди тех, кто не принимал
его (р< 0,05 ).
• Оцените
полученные результаты.
• Укажите
причины, повлиявшие на результаты
исследования.
• Сделайте
предварительный вывод об эффективности
препарата.
Задача
5.
Проанализируйте перечисленные методы
медицинского вмешательства. 0 Внутривенные
инъекции. 0 Пероральная форма ЛС. 0
Мануальная терапия. 0 Иглорефлексотерапия.
0 Оперативное вмешательство.
• Определите
возможные трудности стандартизации и
дозиметрии указанных методов.
• Дайте
обоснование принятого решения.
Задача
6.
При отсутствии адекватного лечения
больные СПИДом погибают в течение
нескольких лет после появления симптомов.
Изучению эффективности методов
лечения больных СПИДом препятствует
нарушение обычных процедур рандомизированных
испытаний, поскольку пациенты хотят
увеличить свои шансы на выживание. В
ходе рандомизированных испытаний
пациенты иногда обмениваются препаратами
или получают через «лекарственные
клубы» препараты, не используемые в
испытании. О таких поступках они не
сообщают исследователям, поэтому
эти факторы невозможно учесть при
подведении итогов испытания.
• Определите,
каким образом такое вмешательство в
исследование оказывает влияние на
получаемые результаты.
Задача
7.
При проведении КИ нового антибиотика
была произведена выборка больных
пневмонией легкой формы течения.
Случайным образом были сформированы
четыре группы пациентов. В первой
группе вмешательство не проводили,
наблюдение за состоянием пациента не
было установлено; за пациентами второй
группы было установлено наблюдение;
в третьей группе пациенты получали
плацебо;
в
четвертой — исследуемый препарат. Через
неделю была проведена оценка эффективности
лечения. Критерий эффективности —
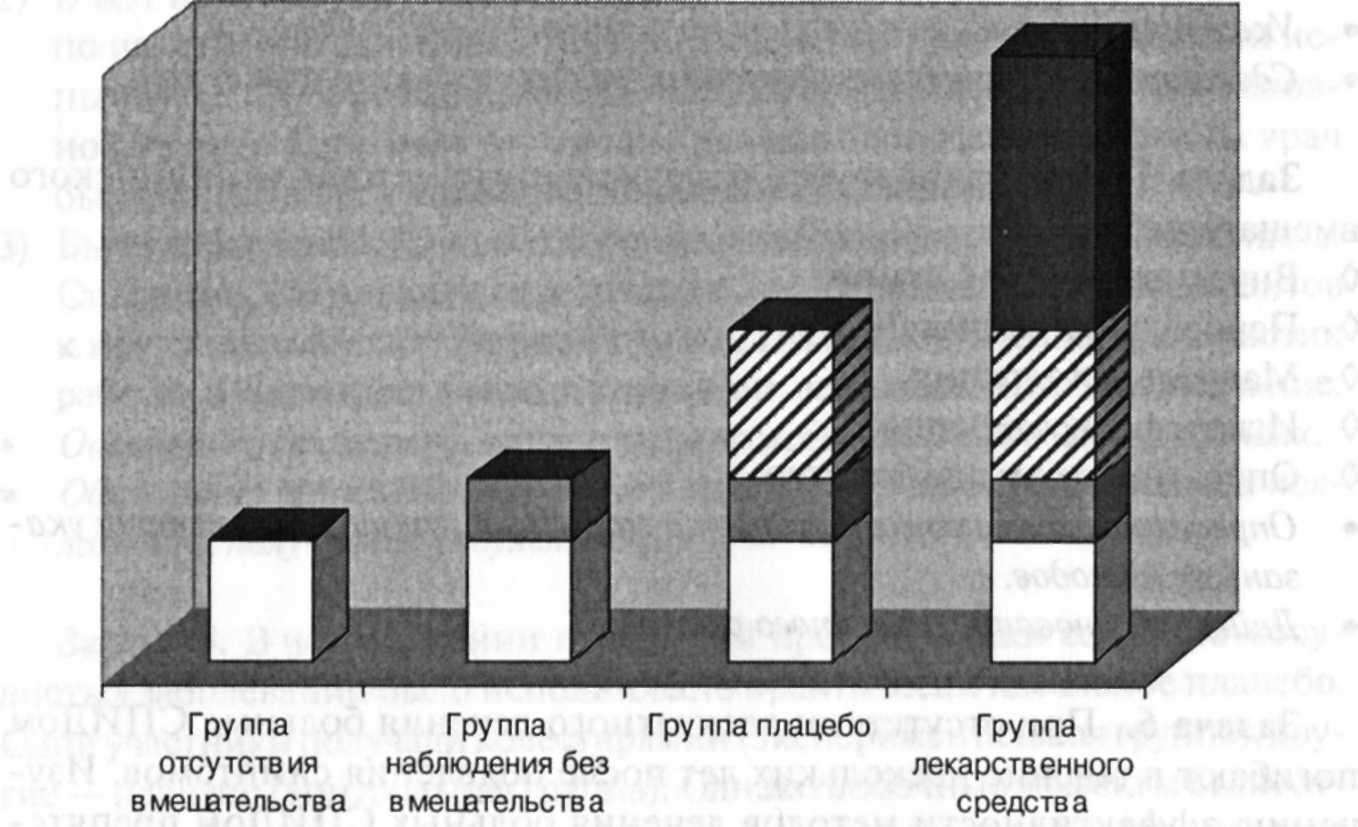
клиническое улучшение состояния. В
первой группе улучшение состояния
отмечено у 15 % пациентов, во второй —
у 23 %, в третьей — у 35 %, в четвертой —
у 85 %.
Рис.
4-4. Вклад различных причин в суммарный
лечебный эффект
• Оцените
полученные результаты.
• Проанализируйте
представленный материал (рис. 4-4) и
оцените вклад различных причин в
суммарный лечебный эффект, дайте
объяснение полученным результатам.
• Укажите
причины, повлиявшие на результаты.
Задача
8. При проведении РКИ эффективности
препарата арбидол среди детей в возрасте
от 2 до 6 лет было сформировано две группы:
основная (экспериментальная) группа
численностью 143 пациента и контрольная
— 151 пациент. Пациенты основной группы
получали арбидол в дозе 0,05 в течение 6
дней, пациенты контрольной группы
получали плацебо. Исследование шло в
течение 3-х мес, после чего оценивали
результаты по числу заболевших гриппом
и ОРВИ, а также число случаев осложнений
гриппа и ОРВИ. В опытной группе заболели
66 пациентов, при этом
осложнения
были у 7 из них, в контрольной группе
заболели 95 пациентов, осложнения
были у 20.
• Оцените
эффективность препарата Арбидол по
предотвращению развития заболевания
гриппом, ОРВИ и осложнений.
Задача
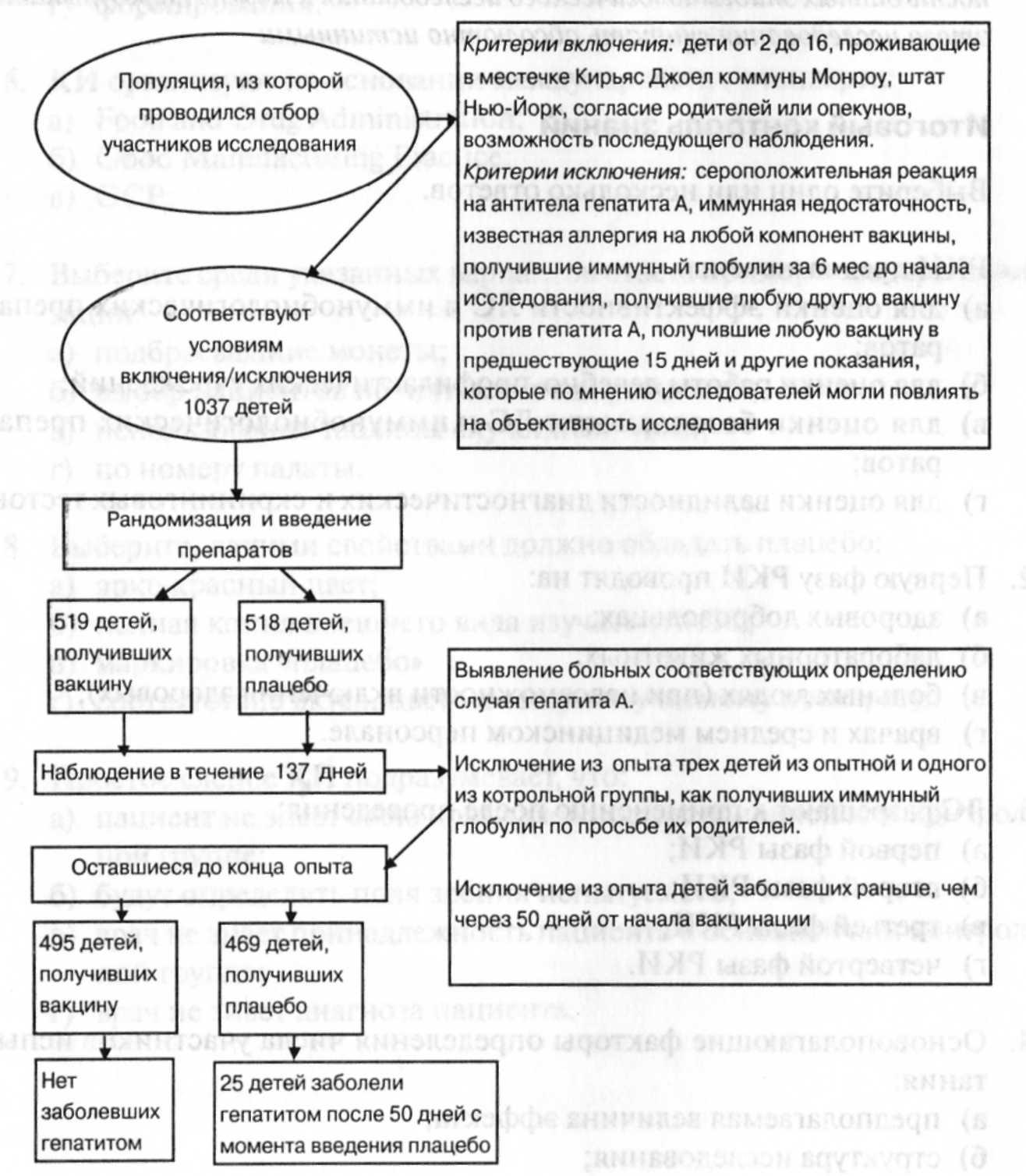
9. Схема составлена на основании данных,
изложенных в публикации
«Формалин-инактивированная вакцина
гепатита А, Приложение 1. А. Верзбергер
и др.New
England Jornal of Medicine.
327 (7), 1992).
• Изучите
представленную схему и составьте ее
заголовок.
• Укажите,
какими терминами следует обозначить
дизайн данного исследования и
объясните основные его этапы.
• Определите
цель этого исследования.
• Укажите,
какой или какие показатели (величины,
коэффициенты) рассчитываются при
такой организации исследования и
расшифруйте их эпидемиологический
смысл.
• Объясните,
что означают термины внутренняя и
внешняя достоверность данных
эпидемиологического исследования и
можно ли результаты этого исследования
считать абсолютно истинными
Итоговый
контроль знаний
Выберите
один или несколько ответов
1.
РКИ предназначены:
а)
для оценки эффективности ЛС и
иммунобиологических препаратов;
б)
для оценки работы лечебно-профилактических
учреждений;
в)
для оценки безопасности ЛС и
иммунобиологических препаратов;
г)
для оценки валидности диагностических
и скрининговых тестов.
2.
Первую фазу РКИ проводят на:
а)
здоровых добровольцах;
б)
лабораторных животных;
в)
больных людях (при невозможности
включения здоровых);
г)
врачах и среднем медицинском персонале.
3.
ЛС разрешают к применению после
проведения:
а)
первой фазы РКИ;
б)
второй фазы РКИ;
в)
третьей фазы РКИ;
г)
четвертой фазы РКИ.
4.
Основополагающие факторы определения
числа участников испытания:
а)
предполагаемая величина эффекта;
б)
структура исследования;
в)
бюджет планируемого исследования;
г)
заранее установленный порог статистической
значимости обнаружения эффекта.
5.
Формирование выборки основано на
критериях:
а)
включения;
б)
обоснования;
в)
исключения;
г)
формирования.
6.
КИ организуют на основании международного
стандарта:
а)
Food and Drug Administration;
б)
Good Manufacturing Practice;
в)
GCP;
7.
Выберите среди указанных вариантов
ответа пример псевдорандомизации:
а)
подбрасывание монеты;
б)
выбор пациентов по четности года
рождения;
в)
использование таблицы случайных чисел;
г)
по номеру палаты.
8.
Выберите, какими свойствами должно
обладать плацебо:
а)
ярко красный цвет;
б)
полная копия внешнего вида изучаемого
ЛС;
в)
маркировка «плацебо»
г)
соответствие вкуса, цвета и запаха
изучаемому препарату.
9.
Простое слепое К И подразумевает, что:
а)
пациент не знает свою принадлежность
к основной или контрольной группе;
б)
будут определять поля зрения испытуемого;
в)
врач не знает принадлежность пациента
к основной или контрольной группе;
г)
врач не знает диагноза пациента.
Ответьте
на следующие вопросы
1.
Укажите основные варианты распределения
вмешательств, используемые при РКИ.
2.
Перечислите основные особенности
проведения второй, третьей, четвертой
фазы РКИ.
3.
Укажите основные особенности проведения
двойного, тройного и четверного КИ.
4.
Перечислите основные статистические
показатели для измерения эффективности
ЛС.
5.
Перечислите случайные и систематические
ошибки при проведении РКИ.
6.
Укажите, какой стандарт при проведении
КИ используют в РФ.
7.
Перечислите основные документы,
используемые при проведении КИ.
8.
Перечислите основные показатели оценки
эффективности и безопасности
лекарственных и профилактических
препаратов;
9.
Перечислите основные показатели оценки
побочных эффектов вмешательства.
Первый слайд презентации: Систематическая ошибка. Оценка риска систематической ошибки в рандомизированном контролируемом клиническом исследовании
Горбатенко В.С
к.м.н. доцент кафедры клинической фармакологии ВолгГМУ
Изображение слайда
Слайд 2: Два вопроса после прочтения статьи
Могу ли я доверять выводам и результатам полученным в публикации?
Могу ли я применить эти данные в своей практике и помочь своим пациентам?
Изображение слайда
Слайд 3: Выбор больных
Критерии включения в исследование
Критерии исключения из исследования
Информированное согласие на участие в исследовании
Изображение слайда
Слайд 4: Внешняя валидность и случайные ошибки
Случайная ошибка (random error) исследования – это исключительно случайное расхождение между результатами измерения, какого-либо явления в конкретном выборочном исследовании и истинной величиной этого явления. Случайная ошибка в отдельном исследовании может отклонить результат от истины с одинаковой вероятностью в сторону заниженной или завышенной оценки. В отличие от случайной ошибки, систематическая ошибка (см. следующий раздел) смещает результат исследования обязательно либо в одну, либо другую сторону от истинного значения.
Если бы существовали только случайные ошибки, то, несмотря на возможное различие результатов, полученных на небольших выборках, среднее значение серии исследований достаточно надежно соответствовало бы истинному значению измеряемого явления
В более масштабных исследованиях возможно погашение случайных ошибок, и его результат приближаются к наиболее оптимальному
Изображение слайда
Слайд 5: Предотвращение случайных ошибок
Основной способ уменьшения случайной ошибки – составление репрезентативной выборки, как по объему, так и по признакам популяции. Полностью исключить случайную ошибку невозможно, но следует ее минимизировать, тщательно продумывая всю организацию предстоящего исследования, не изменяя «на ходу», установленные правила его проведения.
Изображение слайда
Слайд 6: Могу ли я доверять выводам и результатам полученным в публикации?
Систематическая ошибка, или смешение (systematic error, bias) – это непреднамеренное, но регулярное, неслучайное, однонаправленное отклонение результатов измерения от истинного значения.
Истинное значение измеряемого явления
Смещенный результат выборочного исследования
Изучаемая популяция
Изображение слайда
Слайд 7: Виды систематических ошибок (СО) в РКИ
смещение, обусловленное отбором ( selection bias )
смещение, обусловленное вниманием ( performance bias )
смещение, обусловленное неправильной оценкой ( detection bias )
смещение, обусловленное выбыванием участников (attrition bias)
смещение, обусловленное выборочным представлением результатов ( reporting bias )
Смещение, обусловленное влиянием вмешивающихся факторов и модификатов эффекта ( Confounding bias vs Effect modification)
Изображение слайда
Слайд 8: Возникновение систематической ошибки в исследовании
Пациенты
Исследуемая группа
Контрольная группа
Оценка исхода
Публикация
Систематические ошибки
СО, обусловленная отбором
СО, обусловленная вниманием
СО, обусловленная неправильной оценкой
СО, обусловленная выбыванием участников
СО, обусловленная выборочным представлением результатов
Возникновение систематической ошибки в исследовании
Изображение слайда
Слайд 9: Смещение, обусловленное отбором
Участники включаются или не включаются в исследование на основании характеристик, связанных с фактором риска :
Не включаются пациенты оперированные экстренно
Не включаются пожилые пациенты (проблемы согласия)
Смещение, обусловленное отбором подразумевает отличие пациентов в выборке от пациентов целевой популяции.
Худшим примером такой СО является использование разных принципов отбора для пациентов исследуемой и контрольной группы.
Качественно проведенная рандомизация и сокрытие рандомизации предотвращают появление такого вида СО. Однако такой вид СО достаточно часто встречается в обсервационных исследованиях.
Изображение слайда
Слайд 10: Смещение, обусловленное отбором
Смещение, обусловленное отбором
Метод рандомизации
Сокрытие рандомизационной последовательности
Изображение слайда
Слайд 11: Метод рандомизации
Низкий риск
Высокий риск
таблицы случайных чисел
даты рождения или даты включения в испытание или номера медицинской карты
случайной последовательности чисел, генерируемой компьютером
мнения клинического врача
тасования карт или конвертов
предпочтения пациента
выбрасывания жребия или монеты
результатов лабораторных и других тестов
бросания игральных костей
доступности медицинского воздействия
принцип минимизации
Изображение слайда
Слайд 12: Метод рандомизации
Неопределенный риск выставляется в следующих ситуациях
Рандомизация заявлена, нет описания процесса
Недостаточно полное описание процесса
Заявлена блоковая рандомизация, однако нет данных как проводился выбор блока (таблица случайных чисел, компьютерная рандомизация)
Изображение слайда
Слайд 13: Сокрытие рандомизационной последовательности
Низкий риск
Высокий риск
централизованное распределение (по телефону, через интернет или выполняемое независимой
исследовательской организацией)
общедоступную рандомизационную последовательность (например, легкодоступный список случайных
чисел);
идентичные контейнеры для всех сравниваемых веществ
непронумерованные, незапечатанные или прозрачные конверты;
запечатанные конверты
другой метод, который с очевидностью не позволяет скрыть последовательность распределения
Изображение слайда
Слайд 14: Смещение, обусловленное вниманием
Данная систематическая ошибка возникает в связи с повышенным вниманием к исследуемой группе по сравнению с контрольной.
Механизм возникновения данной СО связан с Хоторнским эффектом.
Пациенты из экспериментальной группы и лечащий персонал знают, и в связи с этим меняют свое поведение. Врачи чаще осматривают пациентов и уделяют больше внимания на визитах. Пациенты обращают внимания на самые незначительные изменения в своем состоянии.
Изображение слайда
Слайд 15: Кого ослепляют?
Вероятное ослепление
Вероятно ослепление отсутствует
Плацебо-контролируемое исследование
Активный контроль сравнение двух препаратов.
Нет указания на то, что пациент получает 2 препарата. No mention double dummy.
Активный контроль сравнение двух препаратов. Пациент получает сразу два препарата одновременно. Double dummy design.
Исследование нелекарственных методов лечения
В публикации отсутствуют четко сформулированное описания ослепления пациентов, персонала, лиц оценивающих исходы
Изображение слайда
Слайд 16: Ослепление с помощью плацебо ( double dummy)
Основная группа
Группа контроля
Пациент получает таблетку тофацитиниба + плацебо в форме метотрексата
Пациент получает таблетку метотрексата + плацебо в форме тофацитиниба
Таблетки приходят централизовано в контейнерах ( таблетницах ) персонально для каждого пациента
Тофацитиниб + плацебо в форме Метотрексата
Плацебо в форме + Метотрексат
тофацитиниба
Изображение слайда
Слайд 17: Виды ослепления
Кто знает о лечении
Пациент
Врач
Статистика
Открытое
Да
Да
Да
Простой слепой дизайн
Нет
Да
Да
Двойной слепой дизайн
Нет
Нет
Да
Тройной слепой дизайн
Нет
Нет
Нет
Изображение слайда
Слайд 18: Смещение, обусловленное неправильной оценкой
Кто оценивает исход?
Пациент
Медик
Другие лица
Есть ли ослепление при оценке исхода?
Процедура ослепления эффективна?
Сам исход является объективным или субъективным?
Изображение слайда
Слайд 19: Смещение, обусловленное неправильной оценкой
Низкий риск
Высокий риск
Ослепление было заявлено, нет оснований предполагать, что оно могло быть нарушено
Отсутствие ослепления, исход субъективный
Отсутствие ослепление не могло повлиять на оценку исхода (изучаемый исход объективный)
ослепление» было заявлено, но есть основания предполагать, что оно могло быть нарушено (например, исследователи не предупредили пациентов, знающих о проводимом им вмешательстве, о неразглашении этой информации лицам, оценивающим эффект; лечение и оценка эффекта проводились одним и тем же врачом, который мог догадаться о производимом пациенту вмешательстве в процессе лечения
Изображение слайда
Слайд 20: Смещение, обусловленное неправильной оценкой
Изображение слайда
Слайд 21: Смещение, обусловленное неправильной оценкой
Изображение слайда
Слайд 22: Смещение, обусловленное выбыванием участников
Сколько пропусков данных об исходах в каждой группе?
Какие причины выбывания пациентов из исследования в каждой группе?
Как восполнялась потеря данных?
Изображение слайда
Слайд 23: Смещение, обусловленное выбыванием участников
Низкий риск
Высокий риск
Отсутствуют потерянные данные
доля пропусков в данных об исходах составляет более 20%;
Возникновение пропусков в данных об исходах скорее всего не связано с эффектом вмешательства
доля пропусков в данных об исходах не превышает 20%, но был использован неадекватный метод
восстановления пропущенных данных
Доля пропусков в данных об исходах не превышает 20%, и при этом пропуски равномерно
распределены между группами сравнения
пропуски в данных об исходах скорее всего связаны с эффектом вмешательства, которое привело к
неравномерному распределению пропусков данных
Адекватный метод восстановления пропущенных данных (использование информации, полученной при
последнем визите пациента)
Изображение слайда
Слайд 24: Смещение, обусловленное выбыванием участников
Изображение слайда
Слайд 25: Смещение, обусловленное выбыванием участников
Изображение слайда
Слайд 26: Смещение, обусловленное выборочным представлением результатов
Низкий риск
Высокий риск
есть информация о том, какие исходы были запланированы для изучения в исследовании (например, в протоколе исследования, в регистрах клинических исследований, в предварительных публикациях и т. п.), и результаты по всем заявленным исходам были представлены в отчетах об исследовании
представлены результаты дополнительных основных исходов, которые не были заявлены до начала
исследования (исключая случаи, когда их включение в исследование было обоснованным, например
при появлении непредвиденного побочного эффекта);
нет информации о том, какие исходы были запланированы для изучения в исследовании, но в отчетах об исследовании ясно указано, что были приведены результаты по всем заявленным в протоколе
исходам
результаты по основным исходам получены на основании незаявленных методов измерения и анализа
данных (например, на основании лишь части оценочной шкалы и т. п.);
представлены результаты не по всем основным исходам заявленным до начала исследования
Изображение слайда
Слайд 27: Смещение, обусловленное влиянием вмешивающихся факторов
Другие возможные источники систематических ошибок, например:
конфликт интересов
сложный дизайн исследования (более двух групп сравнения, перекрестный план, последовательный план и т. д.);
отклонение от протокола исследования, противоречащее стандартам надлежащей клинической практики (GCP – good clinical practice);
недостаточная длительность исследования для оценки заявленных в протоколе клинических исходов;
малый размер выборки (менее 20 наблюдений хотя бы в одной из групп).
Изображение слайда
Слайд 28: Инструменты для контроля систематических ошибок
СО, обусловленная отбором
СО, обусловленная вниманием
СО, обусловленная неправильной оценкой
СО, обусловленная выбыванием участников
СО, обусловленная влиянием вмешивающихся факторов
Рандомизация
Другие источники СО
Соответствие заявленным данным в протоколе
Ослепление лиц, оценивающих вмешательство
Ослепление участников и персонала
СО, обусловленная выборочным представлением результатов
Сокрытие рандомизации
Оценка полноты данных об исходах
Изображение слайда
Слайд 29: Валидированный опросник Cochrane
Изображение слайда
Слайд 30: Оценка риска систематической ошибки в РКИ тофацитиниба
Изображение слайда
Слайд 31: Метод рандомизация и сокрытие последовательности
Изображение слайда
Слайд 32: Ослепление в рамках исследования
Изображение слайда
Слайд 33: Выбывание пациентов
Изображение слайда
Слайд 34: Интерпретация результатов
Высокий риск систематической ошибки, хотя бы в одном домене говорит о высоком риске СО во всем исследовании.
Изображение слайда
Последний слайд презентации: Систематическая ошибка. Оценка риска систематической ошибки в рандомизированном: Выводы
Систематическая ошибка может изменить эффект вмешательства и окажет влияние на итоговые результаты.
Кокрановский опросник – это лишь инструмент для оценки риска систематической ошибки. Он используется кокрановским сотрудничеством для оценки РКИ перед включением в мета-анализ.
Высокий риск систематической ошибки не означает, что препарат плохой или совсем не работает. Однако, эффективность и безопасность в реальной клинической практике могут быть иными.
Перед началом своего исследования стоит ознакомится с лучшими и худшими практиками в своем направлении и не совершать ошибок.
Изображение слайда
15 Mar 2013
УДК 614 (072).
А.М. Раушанова
Казахский Национальный медицинский Университет им. С.Д.Асфендиярова
Обязательным условием хорошо спланированного экспериментального исследования является проведение рандомизации. Дословный перевод с английского «random» означает «сделанный или выбранный наугад, случайный, беспорядочный». Эталонным дизайном клинических исследований является рандомизированное контролируемое исследование.
Ключевые слова: рандомизированное контролируемое исследование, рандомизация, «золотой стандарт».
Рандомизированное контролируемое исследование – наиболее точный способ выявления причинно-следственных связей между лечением и исходом заболевания, а также определения экономической эффективности лечения. По некоторым данным, на сегодняшний день около 20% статей, публикуемых в ведущих медицинских журналах мира, содержат результаты рандомизированных исследований [1]. Под рандомизацией понимают процедуру, обеспечивающую случайное распределение больных в экспериментальную и контрольную группы. Следует особо подчеркнуть, что рандомизацию проводят уже после того, как больной включен в испытание в соответствии с протоколом клинического исследования. Специалисты, занимающиеся этой проблемой, подчеркивают, что случайное, или рандомизированное, разделение не является синонимом беспорядочного, при котором процесс разделения не поддается математическому описанию [2]. Рандомизация считается плохо организованной при разделении больных на группы по номеру истории болезни, страхового полиса или дате рождения. Лучше всего пользоваться таблицей случайных чисел, методом конвертов или путем централизованного компьютерного распределения вариантов лечения [3]. К сожалению, упоминание о процессе рандомизации не означает правильного ее проведения. Очень часто в статьях не указывается способ рандомизации, что ставит под сомнение хорошую организацию исследования [4].
Некоторые исследователи предпочитают перед началом испытания распределить пациентов по подгруппам с одинаковым прогнозом и только потом рандомизировать их отдельно в каждой подгруппе (стратификационная рандомизация). Корректность стратификационной рандомизации признается далеко не всеми.
В рандомизированных контролируемых испытаниях (РКИ) участников случайным образом распределяют по группам с помощью процесса, аналогичного подбрасыванию монеты. Одни пациенты попадают в опытную группу (например, лечебную), а другие — в контрольную (например, в группу получающих плацебо). За обеими группами ведут наблюдение в течение определенного времени и проводят анализ исходов, формулируемых в начале исследования (например, летальный исход, инфаркт миокарда, концентрация холестерина в сыворотке и т.д.). Поскольку в среднем группы идентичны (за исключением проводимого вмешательства), теоретически любые изменения в исходах должны обусловливаться изучаемым вмешательством. Тем не менее на практике все не так гладко.
Исследования могут быть одноцентровыми или многоцентровыми. В одном лечебном учреждении за короткий срок очень трудно сформировать выборку, однородную по всем прогностическим признакам (одноцентровой), поэтому в испытания часто включаются несколько учреждений (многоцентровые исследования) многоцентровые РКИ, когда исследования по одному и тому же протоколу производятся сразу в нескольких медицинских центрах. Вместе с тем, проведение крупных многоцентровых клинических испытаний необходимо в следующих ситуациях [5]:
- Когда польза лечения не большая или трудно ее выделить из спонтанной естественной вариабельности эволюции заболевания.
- Когда группы подвергнутых фармакотерапии пациентов гетерогенны и только для относительно небольшой части из них фармакотерапия будет эффективной.
Рандомизированные исследования могут быть открытыми и “слепыми” (маскированными). Открытым рандомизированное испытание считается в том случае, если и пациент, и врач сразу после проведения рандомизации узнают о том, какой вид лечения будет применен у данного больного. При слепом исследовании больному не сообщается о виде применяемого лечения, и этот момент обговаривается с пациентом заранее при получении информированного согласия на исследование. Врач узнает, какой вариант лечения получит больной, после процедуры рандомизации. При выполнении двойного слепого исследования ни врач, ни пациент не знают, какое из вмешательств применяется у конкретного пациента. В тройном слепом исследовании о типе вмешательства не знают больной, врач и исследователь (статистик), обрабатывающий результаты исследования [6].
Специалисты, имеющие дело с рандомизированными исследованиями, отмечают их трудности. Одна из серьезных проблем – сложность отбора пациентов (обычно в исследования, какими бы крупными они не были, можно включить только 4-8% больных из всей популяции с данным заболеванием). Это приводит к снижению обобщаемости результатов на популяцию, т.е. доказанные в исследовании результаты можно распространять только на больных, идентичных по своим характеристикам тем, которые включены в рандомизированные исследования. Следовательно, результаты одной клинической практики не всегда можно рекомендовать для использования в других условиях без проверки новым экспериментальным исследованием. Необходимо отметить, что сам принцип рандомизированных исследований не исключает получения ошибочных результатов при анализе и возможности статистических манипуляций.
Результаты нескольких рандомизированных исследований по какой-то проблеме могут объединяться. Количественный анализ объединенных результатов нескольких клинических испытаний одного и того же вмешательства называют мета — анализом . За счет увеличения размера выборки при мета — анализе обеспечивается большая статистическая мощность, чем в каждом отдельном испытании. Важно, однако, помнить, что некорректно проведенный мета-анализ может вводить в заблуждение из-за недостаточной сопоставимости групп больных и условий проведения лечения в различных исследованиях [7].
РКИ — «золотой стандарт» при проведении медицинских исследований. Однако это положение истинно только при определенных типах клинических вопросов. Обычно все эти вопросы касаются вмешательств, как правило, терапевтических, или профилактических мероприятий. Следует, однако, помнить, что даже при проведении медицинских вмешательств (и уж особенно если их не проводят) РКИ обладают рядом важных недостатков.
Недостатки рандомизированных контролируемых испытаний
Проведение РКИ дорого и требует времени, поэтому в практической деятельности:
• многие испытания либо не проводят вообще, либо проводят на слишком маленькой группе пациентов или в течение слишком короткого периода времени;
• большинство испытаний оплачивают крупные исследовательские институты, университеты, правительство или фармацевтические компании, которые в конечном итоге диктуют направление исследований;
• вместо клинических исходов часто используют суррогатные конечные точки (косвенные критерии оценки).
Скрытые систематические ошибки, возникающие при проведении РКИ, могут возникать в результате следующих причин:
• несовершенная рандомизация
• отсутствие рандомизации всех пациентов, пригодных для исследования (исследователь включает в испытание только тех пациентов, которые, по его мнению, будут хорошо отвечать на данное вмешательство);
• исследователи (вопреки плану) осведомлены, в какой группе находится тот ли иной пациент (т.е. не проводится ослепление).
Преимущества рандомизированных контролируемых испытаний
• Четкая оценка одиночной переменной (например, эффект лекарственного препарата по сравнению с плацебо) в строго определенной группе пациентов (например, женщины в менопаузе в возрасте 50—60 лет)
• Проспективный дизайн (т.е. данные накапливают после того, как вы решили провести исследование)
• Гипотетико-дедуктивный подход (т.е. попытка провести фальсификацию, а не подтвердить собственную гипотезу;)
• Потенциальное исключение ошибки путем сравнения двух в остальном идентичных групп
• Возможность проведения в последующем мета-анализа (комбинирование количественных результатов из нескольких подобных исследований) [8].
Резюмируя сказанное, нужно отметить, что в настоящее время в мировой практике “золотым стандартом” считаются рандомизированные контролируемые (проспективные) испытания с двойным или тройным “слепым” контролем. Эти исследования относятся к так называемому I классу исследований. Материалы этих испытаний и проведенный на их основе мета-анализ должны использоваться в медицинской практике в качестве источника наиболее достоверной информации.
Для того, чтобы результаты доказательных исследований могли быть внедрены в практику, следует четко описывать те категории пациентов, лечение которых изучалось. Читатели должны сравнить их с теми больными, которых им приходится лечить. Для решения этой задачи обязательным является детальное описание и строгое соблюдение критериев включения больных в исследование и исключения из него. Желательно, чтобы эти критерии оценивались теми средствами, которые доступны в повседневной практике[9].
СПИСОК ЛИТЕРАТУРЫ
1 Brazzi L., Bertolini G., Minelli C. Meta-analysis versus randomised controlled trials in intensive care medicine// Intens. Care Med. – 2000 – Vol. 26. – P. 239-241.
2 Epstein A.E., Bigger J.T., Wyse B.J. et al. Preliminary report: Effect of encainid and flecainid on mortality in a randomized suppression after myocardial infarction // N. Engl. J. Med.– 1989.– Vol. 321.– P. 406-412.
3 Graf J., Doig G.S., Cook D.J., Vincent J.-L., Sibbald W.J. Randomizes, controlled clinical trials in sepsis: Has methodological quality improved over time? // Crit. Care Med.– 2002.–Vol. 30, No 2.– P. 461-472.
4 Healy D.P. New and emerging therapies for sepsis // Ann. Pharmacother.– 2002.– Vol. 36, No 4.– P. 648-654.
5 Hйbert P.C., Cook D.J., Wells G., Marshall J. The design of randomized clinical trials in critically ill patients // Chest.– 2002.– Vol. 121.– P. 1290-1300.
6 Kanji S., Devlin J.W., Piekos K.A., Racine E. Recombinant human activated protein C, drotrecogin alfa (activated): A novel therapy for severe sepsis // Pharmacotherapy.–2001.– Vol. 21, No 11.– P. 1389-1402.
7 Самородская И.В. Клинические исследования: контролируемые и рандомизированные // Новости науки и техн. Сер. Медицина. Вып. Реаниматология. Интенсивная терапия. Анестезиология.– 2002.– № 2.– С. 19-22.
8 Ступаков И.Н., Самородская И.В. Рандомизированные исследования – проблемы и перспективы // Бюлл. НЦССХ им. А.Н. Бакулева РАМН.– 2001.– Том 2, № 5.– С. 12-15.
9 Болякина Г.К., Закс И.О. Примеры рандомизированных исследований в интенсивной терапии (по материалам журнала «Critical Care Medicine» // Новости науки и техн. Сер. Медицина. Вып. Реаниматология. Интенсивная терапия. Анестезиология.– 2002.– № 2.– С. 22-28.
А.М. Раушанова
РКЗ — медициналық зерттеулер кезінде «алтын стандарт»
Түйін: Жоспарланған эксперименталдық зерттеу міндет шарты ол рандомизацияны жүргізу. Ағылшын тілінен «random» сөзбе-сөз аударылымы ол «Істелген немесе тәуекелдеп сайлаулы, кездейсоқ, ретсіз» деген мағынаны білдіреді. Клиникалық зерттеу эталондық дизайны рандомизирлық бақыланбалы зерттеу.
Түйінді сөздер: рандомизирлық бақыланбалы зерттеу, рандомизация, «Алтын стандарт».
A.M. Raushanova
RCT — «gold standard» in medical research.
Resume: Obligatory condition well-designed experimental study is to provide randomization. The literal translation of English «random» means «made or chosen at random, casual, messy.» Reference design of clinical trials is a randomized controlled study.
Keywords: a randomized controlled trial, randomization, the «gold standard.»
РКИ — «ЗОЛОТОЙ СТАНДАРТ» ПРИ ПРОВЕДЕНИИ МЕДИЦИНСКИХ ИССЛЕДОВАНИЙ
Подборка по базе: ок1709 практическое задание по психологии 2 Основные психологиче, философия, семинар.docx, Социология семинар.docx, 14 Основные направления 2020-22годы.docx, задание на семинар .docx, Задание к семинару №3 (для уровня Beginner) по дисциплине Англий, Задание к семинару №1 по дисциплине Психология общения (1).docx, Задание к семинару №1 по дисциплине Микроэкономика.docx, Задание к семинару №1 по дисциплине Иностранный язык (для уровня, алина семинар1 философия.docx
В научной и практической работе этот раздел анализа чаще называют «анализом заболеваемости по территории»
Признаки «места» весьма многочисленны и ими могут быть любые признаки, позволяющие определить территориальную «привязанность» отдельного случая. Сравнение уровней заболеваемости населения разных территорий позволяет распределить их по степени риска заболеть какой-либо болезнью. Так же как и при группировке по признакам времени, наибольшей эпидемиологической информативностью обладают данные, полученные при территориальной группировке, учитывающей место действия факторов риска.
Содержание и методы изучения заболеваемости групп, выделенных по признаку «места» не отличаются от содержания и методов, применявшихся при анализе заболеваемости групп, выделенных по индивидуальным признакам. При необходимости выявляются и сравниваются различные особенности распределений годовых и месячных показателей заболеваемости, как всего населения изучаемых территорий, так и разных групп на тех же территориях. Различия состоят в том, что применяются:
- дополнительная статистическая обработка (метод стандартизации) общих показателей заболеваемости населения сравниваемых территорий, связанная с тем, что нередко приходится сравнивать показатели заболеваемости населения территорий с различной демографической структурой.
- дополнительные способы графического отображения данных: построение картограмм и картодиаграмм.
Тема занятия: НАБЛЮДАТЕЛЬНЫЕ АНАЛИТИЧЕСКИЕ ЭПИДЕМИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ (выявление и оценка факторов риска).
Цель занятия: Изучить основные способы выявления и оценки причин (факторов риска) заболеваний различной этиологии.
В результате изучения темы студенты должны знать:
- классификацию наблюдательных аналитических эпидемиологических исследований;
- принцип аналитических эпидемиологических исследований;
- классификацию причин и возможные следствия болезней;
- общенаучные методы познания, отличие наблюдения от эксперимента, область приложения гипотез исследователя;
- принцип проведения ретроспективных и «проспективных» эпидемиологических исследований;
- принцип сплошных и выборочных эпидемиологических исследований;
- этапы проведения когортного исследования, четыре схемы;
- достоинства и недостатки когортного исследования;
- этапы проведения исследований случай-контроль;
- достоинства и недостатки исследования случай-контроль;
- принцип проведения экологических исследований;
- принцип проведение ретроспективного эпидемиологического анализа;
- принцип проведения одномоментные исследование
В результате изучения темы студенты должны уметь:
- оценивать правильность организации и проведения наблюдательных аналитических исследований;
- проводить логическую и статистическую обработку данных, полученных в результате когортных и случай-контроль исследованиях;
Перечень вопросов для изучения темы:
- Какие цели в эпидемиологии реализуются благодаря эпидемиологическим исследованиям?
- Что является результатом проведенного аналитического исследования?
- Сравнительная характеристика исследования случай-контроль и когортного исследования.
- Организация когортных исследований:
- определение популяции, из которой будет формироваться когорта и процесс ее формирования;
- выявление факта воздействия каждого из изучаемых факторов риска на каждое лицо когорты и заполнение первичных учетных документов;
- определение периода наблюдения за когортой;
- формирование основных и контрольных групп;
- динамическая оценка и учет состояния здоровья лиц, включенных в когорту;
- статистический и логический анализ полученных данных.
5. Источники случайных и систематических ошибок в когортных исследованиях;
6. Эпидемиологический смысл абсолютного риска, атрибутивного риска, относительного риска, этиологической доли, добавочного популяционного риска.
7. Организация исследований случай-контроль:
- определение генеральной совокупности (популяции);
- формирование основной и контрольной групп;
- выявление в основной и контрольной группах лиц, подвергавшихся и не подвергавшихся воздействию предполагаемых факторов риска;
- статистический и логический анализ полученных данных и формулирование выводов;
8. Эпидемиологический смысл вероятности воздействия изучаемого фактора, шансов и показателя отношения шансов.
9. Источники случайных и систематических ошибок в исследовании случай-контроль.
10. Отличие экологического (корреляционного) исследования от исследований случай-контроль и когортного.
11. Место ретроспективного эпидемиологического анализа в работе врача-эпидемиолога санитарной службы.
12. Цель одномоментных эпидемиологических исследований.
I
Классификация эпидемиологических исследований по целям исследования и общенаучным методам:
II
Принцип аналитического исследования.
Поиск ответов на вопросы:
- Почему кто-то болеет чаще, а кто-то реже?
- Почему где-то болеют чаще, а где-то реже?
- Почему когда-то болеют чаще, а когда-то реже?
Вопрос «Почему?..» подразумевает поиск причины при известном следствии, или определение следствия от известной причины – в любом случае ставится задача установить причинно-следственную связь между причиной (П) и следствием (С).
Цель данного процесса – предотвратить следствие, т.е. ликвидировать причину. Окончательный «продукт» аналитического эпидемиологического исследования является определение причины или вероятности существования данной причины при известном следствии.
1) Что подразумевается под следствием?
Что является предметом изучения эпидемиологии?
- Заболеваемость.
- Явления, отражающие исходы болезни (смертность, летальность, инвалидизация, ВрУТ, выздоровление).
- Что подразумевается под причиной?
Согласно
основному общенаучному правилу, каждое полноценное аналитическое исследование – наблюдательное или экспериментальное должно иметь, как минимум, 2 сравниваемые группы – основную и контрольную.
III
Наблюдение, Метод гипотез и Эксперимент – общенаучные методы познания.
Френсис Бэкон заложил основу индуктивизма – направление философии, объясняющего процесс познания наблюдением за природой, формулированием гипотез и последующей их проверкой. Эта проверка подтверждает истинность знания или отвергает гипотезу (В.В. Власов, Эпидемиология, М. «ГЭОТАР-МЕД»,2004).
Наблюдение – это метод изучения явления без вмешательства в его естественное течение.
Метод гипотез – это метод основан на мыслительных способностях человека, позволяющих высказывать суждения, умозаключения, формулировать гипотезы и теории.
Эксперимент – метод, который предусматривает вмешательство в изучаемое явление. Вмешательство должно быть точно фиксируемым, контролируемым и воссоздаваемым.
Ни одно исследование не может начаться без идеи, мысленного предвосхищения результатов, без гипотезы, и тем более, без использования метода гипотез невозможно сформулировать выводы исследования.
IV
Ретроспективные и Проспективные эпидемиологические исследования.
Ретроспективные ЭИ — это исследование, которое основано на изучении информации о возникших случаях болезни за какой-либо период времени в прошлом, например, существующая система регистрации и учета больных, архивные истории болезни и т.д.
Проспективные ЭИ – это исследования, которые предусматривают изучение информации по мере появления новых случаев болезни, не существовавших к началу исследования.
V
Наблюдательные аналитические (обсервационные) эпидемиологические исследования.
Наблюдательные аналитические исследования проводятся в естественных условиях возникновения и распространения болезни, т.е. без вмешательства в этот процесс или когда какое-то вмешательство, стало обычным “естественным” мероприятием. Примером может быть изучение заболеваемости населения инфекцией, в отношении которой десятки лет проводится иммунизация.
Главное достоинство таких исследований простота их проведения, что связано с тем, что в них обычно используют официальные данные регистрации заболеваний и их исходов и официальную информацию о вероятных факторах риска. Например, данные о состоянии внешней среды, об экономическом состоянии различных групп населения индивидуальных особенностях.
В наблюдательных исследованиях наиболее ярко проявляется общее правило – любые аналитические исследования начинаются с описательного этапа. Выявление значимых различий в проявлениях заболеваемости различных групп населения, является основой для выработки рабочих гипотез о факторах риска возникновения и распространения болезни. И только после формирования «созревания» рабочей гипотезы приступают к ее проверке в аналитических исследованиях.
По особенностям организации выделяют два основных типа наблюдательных аналитических исследований:
- исследование случай контроль («контрольные случаи»),
- когортное исследование,
Дополнительными вариантами аналитических исследований являются:
- экологические (корреляционные) исследования
- ретроспективный эпидемиологический анализ (этот термин и, определяемые им действия – особенность отечественной эпидемиологии).
- одномоментные исследования (могут проводиться и как описательные исследования, или как аналитические).
В дополнительных вариантах выделение групп сравнения, чаще всего носит формальный характер, поэтому их нельзя в полной мере считать полноценными аналитическими исследованиями, хотя результаты таких исследований позволяют сделать предварительные выводы о причинах возникновения и распространения изучаемой болезни.
- Когортные эпидемиологические исследования (КЭИ).
Цель КЭИ: выявление причин возникновения и распространения болезней.
Это наиболее прямой путь к выявлению этиологии болезней и количественной оценке риска воздействия причинных факторов.
Когорта – а) войсковое подразделение, десятая часть легиона в Древнем Риме численным составом 360-600 человек, включало 3 манипулы.
б) в переносном смысле – сплоченная группа людей, соратников.
в) в медицине – выборка людей, объединенных общими признаками состояния здоровья, в которой ожидается возникновение случаев болезни.
В любом когортном исследовании поиск причин различных следствий происходит в направлении: от предполагаемой причины к следствию.
Когортное исследование может быть основано на трех видах информации:
- Ретроспективные (архивные) данные – ретроспективные (исторические) КЭИ;
- «Проспективные» данные – проспективные (параллельные) КЭИ;
- Смешанные данные – комбинированные КЭИ.
Четыре схемы КЭИ:
Условные обозначения:
«Группа F+» — экспонированная группа;
«Группа F-» — неэкспонированная группа.
F – фактор риска.
А) Схема организации когортного исследования по выявлению одного фактора риска одной изучаемой болезни:
Пример: В 1949 году в Нью-Йорке началось «проспективное» когортное исследование, целью которого было выявление причинно-следственной связи между краснухой беременных и последующими врожденными заболеваниями, уродствами и гибелью плода.
Б) Данная схема исследования предназначена для выявления одного фактора риска у несколько нозологических единиц. Отличие от варианта А заключается в том, что разделение группы F+ и F- после окончания расчетного периода наблюдения происходит по каждой нозологии отдельно.
Пример: Выявление причинно-следственной связи между курением и заболеваниями, связанными с данным фактором риска (стоматиты, хронические бронхиты, коронарные тромбозы, рак легких и т.д.). Подобное исследование проводилось на когорте английских врачей.
В) Схема организации когортного исследования по выявлению нескольких факторов риска одной изучаемой болезни:
Пример: В Москве и Ленинграде в 1975-1982 гг. было проведено масштабное когортное исследование. Изучение когорты численностью 13,5 тыс. мужчин и женщин позволило подтвердить этиологическую роль в возникновении ИБС факторов, которые называют «большой тройкой» — артериальная гипертензия, курение и гиперхолестеринемия.
Г) Схема организации когортного исследования по выявлению нескольких факторов риска для нескольких нозологий.
Пример: Фраменгемское исследование, начатое в 1949 году для выявления факторов риска сердечно-сосудистых заболеваний.
Этапы проведения когортного исследования (на примере варианта В):
1) определение популяции, из которой будет формироваться когорта и процесс ее формирования, внимание на возможные смещения;
2) выявление факта воздействия каждого из изучаемых факторов риска на каждое лицо когорты и заполнение первичных учетных документов;
3) определение периода наблюдения за когортой;
4) динамическая оценка и учет состояния здоровья лиц, включенных в когорту;
5) формирование основных и контрольных групп (4);
6) статистический и логический анализ полученных данных.
ИСТОЧНИКИ СИСТЕМАТИЧЕСКИХ ОШИБОК В КОГОРТНОМ ИССЛЕДОВАНИИ
- При формировании когорты возможны следующие смещения подбора:
А) Центростремительное смещение (концентрация хронических и серьезных больных и максимальные возможности диагностики и лечения в специализированных центрах);
Б) Смещение популярности (присутствие нетипичных больных);
В) Смещение фильтрации («движение» пациентов от звена первичной медицинской помощи до специализированных центров приводит к их частичному отсеиванию по разным причинам: особенности течения заболевания, социальным причинам, географическим, финансовым, особенностям раннее примененного лечения и т.д.);
Г) Смещение доступности диагностики – вариант смещения фильтрации.
- Во время отслеживания результатов в когортном исследовании источником смещения может быть потеря пациентов:
— потеря более 10% пациентов может привести к заметным неопределенностям в оценках;
— потеря более 20% сделает оценки малопригодными для использования.
- Во время оценки исхода возможны смещения, связанные:
— с отсутствием четких критериев оценки исходов;
— со слабыми диагностическими возможностями;
— со смещением подозрения (более внимательное отношение врача во время обследования пациентов, подвергающихся воздействию фактора риска);
— со смещением ожидания (врач-лаборант, патологоанатом, зная клиническую картину пациента, его анамнез, могут находиться под сильным влиянием знаний о прошлых событиях и прижизненном диагнозе).
Статистическая обработка полученных в КЭИ данных.
Такая таблица заполняется только абсолютными величинами, что позволяет рассчитать следующие показатели:
1. Инцидентность в группах наблюдения (I) (риск при наличии/отсутствия фактора риска)
(incident, risk factor group- RF)
а)
Инцидентность в основной группе (RF+ или Ie):
б)
Инцидентность в контрольной группы (RF—или Io):
(в этих и других формулах: 10n – размерность показателя)
- ОТНОСИТЕЛЬНЫЙ РИСК (OP)
(relative risk — RR)
,
или
Значение относительного риска (RR): используется для ориентировочной оценки причинно-следственной связи между фактором риска и возникновением болезни. При этом:
значение RR равное 1 рассматривается как отсутствие связи между фактором и болезнью;
если величина RR больше 1 считается, что чем больше RR, тем выше риск заболеть тех лиц, которые подвергались воздействию фактора, т.е. изучаемый фактор является фактором риска;
если величина RR меньше 1, значит, риск заболеть экспонированных лиц ниже, чем у тех на кого изучаемый фактор не воздействовал и, следовательно, данный фактор, вероятно, оказывает благоприятное воздействие на здоровье – протективный фактор.
- АБСОЛЮТНЫЙ РИСК (AR) (разница рисков, абсолютная разность рисков, добавочный риск, атрибутивный риск)
(absolute risk, risk difference)
,
или AR= RF+ — RF-

Атрибутивный риск
4. ЭТИОЛОГИЧЕСКАЯ ДОЛЯ (доля добавочного риска)
(attributable fraction — AF, etiological fraction — EF)
1)
2)
5. ДОБАВОЧНЫЙ ПОПУЛЯЦИОННЫЙ РИСК
(attributable population risk – ARP)
, где
AR – абсолютный риск
Ip – инцидентность изучаемого населения
В случае проведения различных профилактических программ в отношении населения, мы можем предположить с учетом добавочного популяционного риска, на сколько устранение изучаемого фактора приведет к снижению заболеваемости конкретной болезнью среди населения.
6. ОТНОШЕНИЕ ШАНСОВ (ОШ)
(odds ratio – OR)
Алгоритм расчета №1:
- Расчет вероятности развития болезни при наличии фактора риска.
a/(a+b)
- Расчет вероятности развития болезни при отсутствии фактора риска.
c/(c+d)
- Расчет шансов на развитие болезни при наличии фактора риска.
Шанс F+ =вероятность при F+/1-вероятность при F+
- Расчет шансов на развитие болезни при отсутствии фактора риска.
Шанс F- = вероятность при F-/1-вероятность при F-
- Расчет отношения шансов (ОШ).
ОШ = Шанс F+ / Шанс F-
Алгоритм расчета №2:
- Расчет шансов на развитие болезни при наличии фактора риска.
Шанс F+ = a/b
- Расчет шансов на развитие болезни при отсутствии фактора риска.
Шанс F- = c/d
- Расчет отношения шансов (ОШ).
ОШ = Шанс F+ / Шанс F-
Алгоритм расчета №3:
- Расчет отношения шансов (ОШ).
Оценивается значение отношение шансов, так же как и относительный риск.
Величина OR < 1 указывает на отсутствие причинно-следственной связи изучаемого фактора и болезни.
Величина OR > 1 указывает на возможную этиологическую роль изучаемого фактора, т.е. на повышенный риск возникновения болезни из-за воздействия данного фактора.
7.2 (хи-квадрат), (критерий Пирсона, коэффициент согласия, критерий соответствия),
необходимый для статистической оценки гипотезы причинно-следственной связи.
Критерий 2, так же как и другие статистические методы оценки различия переменных позволяет принять, или отвергнуть нулевую гипотезу, которая в данном случае утверждает, что выявленные различия в частоте заболеваний в сравниваемых группах определяются исключительно случайной ошибкой.
Величина критерия 2 позволяет:
- оценить достоверность различий заболеваемости в опытной и контрольной группе;
- высказать гипотезу о наличие связи между заболеваемостью и изучаемым фактором.
,
Эта формула применяется, если N больше 40. Однако при этом если одно из значений (a, b, c или d ) в таблице «два на два» будет меньше 5, но больше 0, следует использовать другую формулу (с поправкой Йетса):
В других случаях вместо 2-рекомендуется использовать точный критерий Фишера.
Уровень ошибки и, соответственно, уровень достоверности различий заболеваемости в сравниваемых группах, а, следовательно, и уровень достоверности суждения о наличии связи между фактором и заболеваемостью зависит от значения 2и определяется по таблице 2-распределения (она есть в любом статистическом справочнике). Для таблицы «два на два»:
2= 3,841 соответствует уровню ошибки – р=0,05
2= 6,635 соответствует уровню ошибки — р=0,01
Таким образом, значение 2, позволяющее отвергнуть нулевую гипотезу, должно быть (для таблицы «два на два») не менее 3,841.
Достоинства и недостатки когортных исследований.
Достоинства.
- Главное достоинство когортных исследований – возможность (и нередко единственная) получения достоверной информации об этиологии болезней, особенно в тех случаях, когда эксперимент невозможен.
- Единственный способ оценки показателей абсолютного, атрибутивного, относительного риска возникновения заболевания и оценки этиологической доли случаев, связанных с предполагаемым фактором риска.
- Позволяют выявлять редко встречающиеся причины.
- Позволяют одновременно выявлять несколько факторов риска одного или нескольких заболеваний.
- Достаточно высокая достоверность выводов связанная с тем, что в когортных исследованиях гораздо легче избежать ошибок при формировании основных и контрольных групп, так как они создаются после выявления изучаемых эффектов (заболеваний, смертей и др.).
Главные недостатки.
- Необходимость формирования когорты большой численности, особенно при относительно редко встречающихся болезнях. Чем реже встречается заболевание, тем больше возрастает физическая невозможность создать необходимую когорту.
- Большая продолжительность исследования.
- Высокая стоимость.
- Исследования случай-контроль.
Цель исследования случай-контроль: выявление причин возникновения и распространения болезней. В исследованиях случай-контроль вероятность существования причинно-следственной связи обосновывается не разной частотой заболеваемости, а различной распространенностью (встречаемостью) предполагаемого фактора риска в основной и контрольной группах.
В любом исследовании случай-контроль поиск причин различных следствий происходит в направлении: от следствия к предполагаемой причине.
Исследование случай-контроль может быть только ретроспективным.
Схема проведения выборочного исследования случай-контроль:
Этап деления основной и контрольной группы на подгруппы (a F+, b F-, c F+ и d F-) может повторяться столько раз, сколько факторов риска было выявлено в результате изучения архивных данных.
Этапы проведения исследования случай контроль:
- определение генеральной совокупности (популяции);
- формирование основной и контрольной групп (в идеале: с использованием способа «подбора-пар»);
- выявление в основной и контрольной группах лиц, подвергавшихся и не подвергавшихся воздействию предполагаемых факторов риска;
- статистический и логический анализ полученных данных и формулирование выводов.
ИСТОЧНИКИ СИСТЕМАТИЧЕСКИХ ОШИБОК В ИССЛЕДОВАНИИ СЛУЧАЙ-КОНТРОЛЬ
- Искаженный сбор данных (специалист, зная, с кем он беседует или на кого делает выписки из истории болезни – на пациента основной или контрольной группы, за счет более настойчивого и детального опроса или предвзятой оценки документов может исказить результаты своей работы в угоду изучаемой гипотезе);
- Смещение памяти (систематическая ошибка, связанная с ошибками воспоминания у пациентов);
- Смещения выявления (отличие в диагностике членов основной и контрольной группы: в большинстве ИСК лица, включенные в группу сравнения, не проходят такого диагностического обследования, как больные).
Статистическая обработка полученных данных в исследованиях случай-контроль.
Поскольку в исследованиях случай–контроль невозможно рассчитать показатели абсолютного риска в сравниваемых группах, выраженность причинной ассоциации в исследованиях случай – контроль определяется различиями частоты воздействия (частоты встречаемости) факторов риска в группах сравнения, а не различиями в частоте заболеваний в сравниваемых группах.
Частоту воздействия (встречаемости) факторов риска в этих группах рассчитывают по той же формуле, что и абсолютный риск в когортных исследованиях, т.е. a/(a+b) для основной группы (случаи), и c/(c+d) для контрольной группы.
Рассчитанная частота воздействия отражает значение вероятности воздействия изучаемого фактора в сравниваемых группах.
Значения вероятностей воздействия фактора риска в группах сравнения позволяет рассчитать шансы (odds) воздействия изучаемого фактора в основной и контрольной группах. Шансы – в общем случае, это отношение вероятности того, что событие произойдет, к вероятности того, что событие не произойдет. При расчетах шансов вероятность лучше всего выражать в долях единицы:
Шансы и вероятности содержат одну и ту же информацию, но по-разному, выражают ее.
Например, если вероятность воздействия изучаемого фактора риска в основной группе 0,67 (67,0%) то шансы воздействия равны
0,67/(1–0,67)= 2.
Часто шансы чего-либо, например наличия воздействия фактора риска в основной группе, выражают как соотношение шансов к 1, в данном примере, как 2:1.
Зная величину шансов при необходимости легко рассчитать вероятность:
Так, в предыдущем примере: вероятность = 2/(1+2)=0,67 или 67,0%
В некоторых случаях шансы удобнее использовать, чем вероятности.
В исследованиях случай-контроль различия в частоте встречаемости факторов риска в сравниваемых группах, определяет отношение шансов двух групп, а рассчитываемый показатель называется отношением шансов (коэффициентом асимметрии, odds ratio, OR).
По данным таблицы «два на два» можно не вычислять шансы каждой группы, а отношение шансов рассчитать как:
Оценивается значение отношение шансов, так же как и относительный риск.
Величина OR 1 указывает на отсутствие причинно-следственной связи изучаемого фактора и болезни.
Величина OR >1 указывает на возможную этиологическую роль изучаемого фактора, т.е. на повышенный риск возникновения болезни из-за воздействия данного фактора.
Оценка достоверности результатов исследования случай-контроль проводится с помощью тех же критериев, что и в когортном исследовании.
Достоинства и недостатки исследований случай–контроль.
Достоинства.
- Возможность их проведения не зависит от распространенности изучаемой болезни. Сравнительно небольшие затраты времени, сил и средств необходимы для того чтобы создать основную группу больных, даже редко встречающимися заболеваниями, подобрать к ним контроли, опросить и сделать хотя бы ориентировочные выводы. При изучении таких болезней в когортном исследовании, пришлось бы подобрать когорту из сотен тысяч людей, наблюдать их длительное время, что повлекло бы значительные временные, материальные и моральные затраты.
- Относительно короткая длительность. Для получения выводов не нужно, как в когортном исследовании, проводить наблюдение в течение периода превышающего латентный период развития болезни.
- Возможность одновременно выявлять несколько факторов риска одного заболевания.
- Сравнительно небольшие экономические затраты.
Недостатки.
- Низкая достоверность выводов из-за высокой подверженности систематическим ошибкам.
- Невозможность выявления редко встречающихся причин болезни. В таких случаях, скудные данные не позволяют оценить достоверность различий частоты встречаемости фактора риска в группах сравнения и, следовательно, сделать выводы о наличии/отсутствии причинно следственной связи.
- невозможность количественно оценить риск возникновения болезни (смерти) от предполагаемой причины. В исследовании количественно определяется лишь показатель «отношение шансов».
-
Экологические (корреляционные) исследования
-
Ретроспективный эпидемиологический анализ.
-
Одномоментные исследования. Скрининг.
VI
Выборочные эпидемиологические исследования.
Когда заключения относительно популяции делаются на основании наблюдений в выборке, возникают два фундаментальных вопроса:
- Справедливы ли полученные выводы для всех элементов выборки? – Внутренняя достоверность результатов выборочных ЭИ.
- Отражает ли выборка интересующую нас популяцию? –
Внешняя достоверность результатов выборочных ЭИ.
VII
Задания.
Задача 1.
Табл. Число новых случаев артериальной гипертонии (АГ) в Москве среди женщин 20-69 лет, в зависимости от наличия или отсутствия гиперхолестеринемии (ГХС).
Источник: Эпидемиология неинфекционных заболеваний под редакцией А.М. Вихерта, А.В. Чаклина. Москва «Медицина», 1990
Примечание: различие в частоте новых случаев АГ в опытной и контрольной группе достоверно (p 0,05)
Задание.
1. Укажите возможные недостатки (упущения) в названии таблицы. Назовите тип представленной таблицы. Укажите, какими терминами следует обозначить дизайн данного исследования.
2. Определите цель этого исследования.
3. Укажите, какие показатели (величины, коэффициенты) позволяют рассчитать данные этой таблицы и расшифруйте их эпидемиологический смысл.
4. Объясните, что означают термины внутренняя и внешняя достоверность данных эпидемиологического исследования и можно ли результаты этого исследования экстраполировать на всех женщин 20 — 69 лет.
Задача 2.
Табл. Встречаемость частых ангин в анамнезе больных ревматоидным артритом и в анамнезе здоровых лиц.
Источник. Эпидемиология ревматических болезней. Л.И. Беневоленская,
М.М. Бржезовский. Москва «Медицина»,1988. (с небольшими изменениями).
Примечание: различие в частоте встречаемости частых ангин у больных ревматоидным артритом и здоровых лиц достоверно (p 0,05)
Задание.
1. Укажите возможные недостатки (упущения) в названии таблицы. Назовите тип представленной таблицы. Укажите, какими терминами следует обозначить дизайн данного исследования, и объясните основные его этапы.
2. Определите цель этого исследования.
3. Укажите, какие показатели (величины, коэффициенты) позволяют рассчитать данные этой таблицы и расшифруйте их эпидемиологический смысл.
4. Объясните, что означают термины внутренняя и внешняя достоверность данных эпидемиологического исследования и можно ли результаты этого исследования экстраполировать на всех больных ревматоидным артритом.
Задача 3.
Из 600 пациентов, которым было сделано переливание крови, в течение 2,5 лет 60 лиц заболели гепатитом В, а из 700 пациентов без переливания крови гепатитом в те же сроки заболели только 15. ( Источник: А.Альбом, С Норелл. «Введение в современную эпидемиологию» 1996 г., с незначительными изменениями)
Задание.
1. Оформите представленные данные в виде таблицы « два на два»
2.Укажите какими терминами следует обозначить дизайн данного исследования, и объясните, какими должны быть основные этапы такого исследования .
2. Определите цель этого исследования.
3. Укажите, какой или какие показатели (величины, коэффициенты) рассчитываются при такой организации исследования, рассчитайте некоторые из них и расшифруйте их эпидемиологический смысл.
4. Объясните, что означают термины внутренняя и внешняя достоверность данных эпидемиологического исследования и можно ли результаты этого исследования считать абсолютным доказательством того, что переливание крови является фактором риска
Задача 4.
Ситуация: Во время беременности (особенно первой) многие женщины страдают от приступов гипертензии.
Обобщенная статистическая информация, собранная в Англии в период с 1938 по 1960 года позволила сделать вывод о том, что среди рожавших женщин (в отличие от нерожавших) наблюдалась высокая смертность от сердечно-сосудистых заболеваний, в частности гипертонической болезни и ишемической болезни сердца.
Задание:
- Представьте дизайн эпидемиологического исследования для выявления причинно-следственных связей между беременностью и сердечно-сосудистыми заболеваниями у рожавших женщин.
- Прокомментируйте каждый этап данного исследования.
- Какие показатели (величины, коэффициенты) можно рассчитать по результатам данного исследования?
Задача 5.
Табл. Число смертельных исходов в группе некурящих женщин в возрасте 40-70 лет, проживающих в семи районах Шанхая в зависимости от курения табака их мужьями.
Источник: BMJ, doi:10.1136/ bmj.38834.522894.2F, 12 July 2006.
-
Группы Количество смертей среди женщин Всего да нет мужья курят 662 39 133 39 795 мужья не курят 490 24 895 25 385 Всего 1 152 64 028 65 180
Примечание: различие в частоте новых случаев АГ в опытной и контрольной группе достоверно (p=0,009)
Задание.
1. Представьте дизайн данного исследования.
2. Определите цель этого исследования.
3. Укажите, какие показатели (величины, коэффициенты) позволяют рассчитать данные этой таблицы и расшифруйте их эпидемиологический смысл.
4. Объясните, что означают термины внутренняя и внешняядостоверность данных эпидемиологического исследования и можно ли результаты этого исследования экстраполировать на всех женщин 40-70 лет.
Задача 6.
Вопрос в исследовании случай-контроль: увеличивает ли прием нестероидных противовоспалительных препаратов риск развития заболевания почек?
Задание:
1. Представьте дизайн эпидемиологического исследования.
2. Прокомментируйте каждый этап эпидемиологического исследования.
3. Какие показатели (величины, коэффициенты) можно рассчитать по результатам данного исследования?
Задача 7.
Ситуация: Располагая доступом к информационной системе неотложной медицинской помощи города Сиэтла, штата Вашингтон, задаемся вопросом: предупреждает ли регулярная интенсивная физическая активность риск остановки сердца у лиц без явного заболевания сердечно-сосудистой системы?
Больные были отобраны 163 пациента из 1250 жителей Сиэтла, которые в течение определенного периода времени перенесли вне стационара остановку сердца. Контрольная группа (163 участника) была сформирована по случайно выбранным телефонным номерам того же города (большинство жителей имели домашние телефоны). Обе группы, основная и контрольная должны были удовлетворять единым критериям включения:
- возраст 25-75 лет,
- отсутствие клинически распознаваемого диагноза сердца,
- отсутствие предшествующего заболевания, ограничивающего физическую активность,
- наличие супруги/супруга, которые могли сообщить информацию о привычной физической нагрузке.оступом в информационную дима для иологического исследования.стероидных противовосполительных прерпаратов риск от
Участники контрольной группы соответствовали участникам основной группы по возрасту, полу, семейному положению и месту жительства. Супруги участников обеих групп опрашивались о способе проведения досуга.
В результате опроса супругов и участников исследования выяснилось, что регулярной физической нагрузкой занимались 59 человек из основной группы и 95 человек из контрольной группы.
Задание:
1. Представьте дизайн эпидемиологического исследования.
2. Прокомментируйте каждый этап эпидемиологического исследования.
3. Заполните таблицу «два-на-два» и рассчитайте показатели (величины, коэффициенты) по результатам данного исследования?
Задача 8.
Табл. Встречаемость приема эстрогена в анамнезе больных женщин раком эндометрия и здоровых женщин.
-
Группы Прием эстрогенов Всего да нет Рак эндометрия 985 1129 Здоровые женщины 24 895 Всего 64 028 2258
Задание.
1. Заполните представленную таблицу.
2. Укажите возможные недостатки (упущения) в названии таблицы. Назовите тип представленной таблицы. Укажите, какими терминами следует обозначить дизайн данного исследования, и объясните основные его этапы.
3. Определите цель этого исследования.
4. Укажите, какие показатели (величины, коэффициенты) позволяют рассчитать данные этой таблицы и расшифруйте их эпидемиологический смысл.
Тема занятия: Экспериментальные аналитические эпидемиологические исследования (оценка эффективности и безопасности лекарственных и профилактических препаратов).
Цель занятия: Освоение основных подходов к оценке эффективности и безопасности лекарственных и профилактических препаратов.В результате изучения темы студенты должны знать:
- определение экспериментальных аналитических эпидемиологических исследований, их предназначение;
- определение рандомизированных клинических испытаний (РКИ)
- цели, фазы, организация РКИ;
- случайные и систематические ошибки РКИ;
- основные показатели оценки эффективности и безопасности лекарственных и профилактических препаратов;
- основные стандарты проведения РКИ.
В результате изучения темы студенты должны уметь:
- оценивать правильность организации РКИ;
- проводить оценку статистической и клинической значимости результатов РКИ;
Перечень вопросов для изучения темы:
1. РКИ (рандомизированные клинические испытания). РКИ — «золотой» стандарт экспериментальных исследований по оценке потенциальной эффективности лечебных и профилактических препаратов.
2. Цели РКИ. Оценка безопасности и эффективности (действенность и собственно эффективность). Внутренняя и внешняя достоверность РКИ.
3. Фазы РКИ.
4. Случайные и систематические ошибки.
5. Организация РКИ.
- Планирование числа участников.
- Критерии включения/исключения. Согласие участников. Комплайенс.
- Формирование выборки.
- Рандомизация: цели, методы, ошибки. Псевдорандомизация.
- Распределение и применение вмешательств. Испытания в параллельных группах (независимые и связанные выборки), перекрестное испытание, факторная структура эксперимента, исторический и внешний контроль.
- Дозиметрия применяемого вмешательства (характеристики, методы измерения и стандартизации)
- Плацебо: цели применения плацебо.
- Ослепление (маскирование) исследования: слепое, двойное тройное и четверное слепые испытания.
- Исходы исследования: методы оценки. Клинически важные исходы, промежуточные, косвенные, суррогатные исходы. Качество жизни.
- Прекращение испытания: планирование длительности.
6. Статистическая и клиническая значимость результатов. Показатели величины эффекта. Оценка клинической значимости.
7. Изучение побочных эффектов вмешательства.
8. Стандарт отрасли ОСТ 42-511-99 «Правила проведения качественных клинических испытаний в Российской Федерации». Область применения.
9. Принципы качественных клинических испытаний (GCP – Good Clinical Practice).
10. Основные документы, необходимые для проведения РКИ.
11. Этические аспекты проведения РКИ.
15 Mar 2013
УДК 614 (072).
А.М. Раушанова
Казахский Национальный медицинский Университет им. С.Д.Асфендиярова
Обязательным условием хорошо спланированного экспериментального исследования является проведение рандомизации. Дословный перевод с английского «random» означает «сделанный или выбранный наугад, случайный, беспорядочный». Эталонным дизайном клинических исследований является рандомизированное контролируемое исследование.
Ключевые слова: рандомизированное контролируемое исследование, рандомизация, «золотой стандарт».
Рандомизированное контролируемое исследование – наиболее точный способ выявления причинно-следственных связей между лечением и исходом заболевания, а также определения экономической эффективности лечения. По некоторым данным, на сегодняшний день около 20% статей, публикуемых в ведущих медицинских журналах мира, содержат результаты рандомизированных исследований [1]. Под рандомизацией понимают процедуру, обеспечивающую случайное распределение больных в экспериментальную и контрольную группы. Следует особо подчеркнуть, что рандомизацию проводят уже после того, как больной включен в испытание в соответствии с протоколом клинического исследования. Специалисты, занимающиеся этой проблемой, подчеркивают, что случайное, или рандомизированное, разделение не является синонимом беспорядочного, при котором процесс разделения не поддается математическому описанию [2]. Рандомизация считается плохо организованной при разделении больных на группы по номеру истории болезни, страхового полиса или дате рождения. Лучше всего пользоваться таблицей случайных чисел, методом конвертов или путем централизованного компьютерного распределения вариантов лечения [3]. К сожалению, упоминание о процессе рандомизации не означает правильного ее проведения. Очень часто в статьях не указывается способ рандомизации, что ставит под сомнение хорошую организацию исследования [4].
Некоторые исследователи предпочитают перед началом испытания распределить пациентов по подгруппам с одинаковым прогнозом и только потом рандомизировать их отдельно в каждой подгруппе (стратификационная рандомизация). Корректность стратификационной рандомизации признается далеко не всеми.
В рандомизированных контролируемых испытаниях (РКИ) участников случайным образом распределяют по группам с помощью процесса, аналогичного подбрасыванию монеты. Одни пациенты попадают в опытную группу (например, лечебную), а другие — в контрольную (например, в группу получающих плацебо). За обеими группами ведут наблюдение в течение определенного времени и проводят анализ исходов, формулируемых в начале исследования (например, летальный исход, инфаркт миокарда, концентрация холестерина в сыворотке и т.д.). Поскольку в среднем группы идентичны (за исключением проводимого вмешательства), теоретически любые изменения в исходах должны обусловливаться изучаемым вмешательством. Тем не менее на практике все не так гладко.
Исследования могут быть одноцентровыми или многоцентровыми. В одном лечебном учреждении за короткий срок очень трудно сформировать выборку, однородную по всем прогностическим признакам (одноцентровой), поэтому в испытания часто включаются несколько учреждений (многоцентровые исследования) многоцентровые РКИ, когда исследования по одному и тому же протоколу производятся сразу в нескольких медицинских центрах. Вместе с тем, проведение крупных многоцентровых клинических испытаний необходимо в следующих ситуациях [5]:
- Когда польза лечения не большая или трудно ее выделить из спонтанной естественной вариабельности эволюции заболевания.
- Когда группы подвергнутых фармакотерапии пациентов гетерогенны и только для относительно небольшой части из них фармакотерапия будет эффективной.
Рандомизированные исследования могут быть открытыми и “слепыми” (маскированными). Открытым рандомизированное испытание считается в том случае, если и пациент, и врач сразу после проведения рандомизации узнают о том, какой вид лечения будет применен у данного больного. При слепом исследовании больному не сообщается о виде применяемого лечения, и этот момент обговаривается с пациентом заранее при получении информированного согласия на исследование. Врач узнает, какой вариант лечения получит больной, после процедуры рандомизации. При выполнении двойного слепого исследования ни врач, ни пациент не знают, какое из вмешательств применяется у конкретного пациента. В тройном слепом исследовании о типе вмешательства не знают больной, врач и исследователь (статистик), обрабатывающий результаты исследования [6].
Специалисты, имеющие дело с рандомизированными исследованиями, отмечают их трудности. Одна из серьезных проблем – сложность отбора пациентов (обычно в исследования, какими бы крупными они не были, можно включить только 4-8% больных из всей популяции с данным заболеванием). Это приводит к снижению обобщаемости результатов на популяцию, т.е. доказанные в исследовании результаты можно распространять только на больных, идентичных по своим характеристикам тем, которые включены в рандомизированные исследования. Следовательно, результаты одной клинической практики не всегда можно рекомендовать для использования в других условиях без проверки новым экспериментальным исследованием. Необходимо отметить, что сам принцип рандомизированных исследований не исключает получения ошибочных результатов при анализе и возможности статистических манипуляций.
Результаты нескольких рандомизированных исследований по какой-то проблеме могут объединяться. Количественный анализ объединенных результатов нескольких клинических испытаний одного и того же вмешательства называют мета — анализом . За счет увеличения размера выборки при мета — анализе обеспечивается большая статистическая мощность, чем в каждом отдельном испытании. Важно, однако, помнить, что некорректно проведенный мета-анализ может вводить в заблуждение из-за недостаточной сопоставимости групп больных и условий проведения лечения в различных исследованиях [7].
РКИ — «золотой стандарт» при проведении медицинских исследований. Однако это положение истинно только при определенных типах клинических вопросов. Обычно все эти вопросы касаются вмешательств, как правило, терапевтических, или профилактических мероприятий. Следует, однако, помнить, что даже при проведении медицинских вмешательств (и уж особенно если их не проводят) РКИ обладают рядом важных недостатков.
Недостатки рандомизированных контролируемых испытаний
Проведение РКИ дорого и требует времени, поэтому в практической деятельности:
• многие испытания либо не проводят вообще, либо проводят на слишком маленькой группе пациентов или в течение слишком короткого периода времени;
• большинство испытаний оплачивают крупные исследовательские институты, университеты, правительство или фармацевтические компании, которые в конечном итоге диктуют направление исследований;
• вместо клинических исходов часто используют суррогатные конечные точки (косвенные критерии оценки).
Скрытые систематические ошибки, возникающие при проведении РКИ, могут возникать в результате следующих причин:
• несовершенная рандомизация
• отсутствие рандомизации всех пациентов, пригодных для исследования (исследователь включает в испытание только тех пациентов, которые, по его мнению, будут хорошо отвечать на данное вмешательство);
• исследователи (вопреки плану) осведомлены, в какой группе находится тот ли иной пациент (т.е. не проводится ослепление).
Преимущества рандомизированных контролируемых испытаний
• Четкая оценка одиночной переменной (например, эффект лекарственного препарата по сравнению с плацебо) в строго определенной группе пациентов (например, женщины в менопаузе в возрасте 50—60 лет)
• Проспективный дизайн (т.е. данные накапливают после того, как вы решили провести исследование)
• Гипотетико-дедуктивный подход (т.е. попытка провести фальсификацию, а не подтвердить собственную гипотезу;)
• Потенциальное исключение ошибки путем сравнения двух в остальном идентичных групп
• Возможность проведения в последующем мета-анализа (комбинирование количественных результатов из нескольких подобных исследований) [8].
Резюмируя сказанное, нужно отметить, что в настоящее время в мировой практике “золотым стандартом” считаются рандомизированные контролируемые (проспективные) испытания с двойным или тройным “слепым” контролем. Эти исследования относятся к так называемому I классу исследований. Материалы этих испытаний и проведенный на их основе мета-анализ должны использоваться в медицинской практике в качестве источника наиболее достоверной информации.
Для того, чтобы результаты доказательных исследований могли быть внедрены в практику, следует четко описывать те категории пациентов, лечение которых изучалось. Читатели должны сравнить их с теми больными, которых им приходится лечить. Для решения этой задачи обязательным является детальное описание и строгое соблюдение критериев включения больных в исследование и исключения из него. Желательно, чтобы эти критерии оценивались теми средствами, которые доступны в повседневной практике[9].
СПИСОК ЛИТЕРАТУРЫ
1 Brazzi L., Bertolini G., Minelli C. Meta-analysis versus randomised controlled trials in intensive care medicine// Intens. Care Med. – 2000 – Vol. 26. – P. 239-241.
2 Epstein A.E., Bigger J.T., Wyse B.J. et al. Preliminary report: Effect of encainid and flecainid on mortality in a randomized suppression after myocardial infarction // N. Engl. J. Med.– 1989.– Vol. 321.– P. 406-412.
3 Graf J., Doig G.S., Cook D.J., Vincent J.-L., Sibbald W.J. Randomizes, controlled clinical trials in sepsis: Has methodological quality improved over time? // Crit. Care Med.– 2002.–Vol. 30, No 2.– P. 461-472.
4 Healy D.P. New and emerging therapies for sepsis // Ann. Pharmacother.– 2002.– Vol. 36, No 4.– P. 648-654.
5 Hйbert P.C., Cook D.J., Wells G., Marshall J. The design of randomized clinical trials in critically ill patients // Chest.– 2002.– Vol. 121.– P. 1290-1300.
6 Kanji S., Devlin J.W., Piekos K.A., Racine E. Recombinant human activated protein C, drotrecogin alfa (activated): A novel therapy for severe sepsis // Pharmacotherapy.–2001.– Vol. 21, No 11.– P. 1389-1402.
7 Самородская И.В. Клинические исследования: контролируемые и рандомизированные // Новости науки и техн. Сер. Медицина. Вып. Реаниматология. Интенсивная терапия. Анестезиология.– 2002.– № 2.– С. 19-22.
8 Ступаков И.Н., Самородская И.В. Рандомизированные исследования – проблемы и перспективы // Бюлл. НЦССХ им. А.Н. Бакулева РАМН.– 2001.– Том 2, № 5.– С. 12-15.
9 Болякина Г.К., Закс И.О. Примеры рандомизированных исследований в интенсивной терапии (по материалам журнала «Critical Care Medicine» // Новости науки и техн. Сер. Медицина. Вып. Реаниматология. Интенсивная терапия. Анестезиология.– 2002.– № 2.– С. 22-28.
А.М. Раушанова
РКЗ — медициналық зерттеулер кезінде «алтын стандарт»
Түйін: Жоспарланған эксперименталдық зерттеу міндет шарты ол рандомизацияны жүргізу. Ағылшын тілінен «random» сөзбе-сөз аударылымы ол «Істелген немесе тәуекелдеп сайлаулы, кездейсоқ, ретсіз» деген мағынаны білдіреді. Клиникалық зерттеу эталондық дизайны рандомизирлық бақыланбалы зерттеу.
Түйінді сөздер: рандомизирлық бақыланбалы зерттеу, рандомизация, «Алтын стандарт».
A.M. Raushanova
RCT — «gold standard» in medical research.
Resume: Obligatory condition well-designed experimental study is to provide randomization. The literal translation of English «random» means «made or chosen at random, casual, messy.» Reference design of clinical trials is a randomized controlled study.
Keywords: a randomized controlled trial, randomization, the «gold standard.»
РКИ — «ЗОЛОТОЙ СТАНДАРТ» ПРИ ПРОВЕДЕНИИ МЕДИЦИНСКИХ ИССЛЕДОВАНИЙ
Рандомизированное контролируемое испытание (рандомизированное контролируемое исследование, РКИ) — это тип научного (часто медицинского) эксперимента, целью которого является уменьшение определенных источников систематической ошибки при проверке эффективности новых методов лечения; это достигается путем случайного распределения субъектов в двух или более группах, различного отношения к ним, а затем сравнения их с измеренным ответом. Одна группа — экспериментальная группа — оценивает вмешательство, в то время как другая — обычно называемая контрольной группой — имеет кардинальное отличие, такое как отсутствие вмешательства или использование плацебо. Группы иследуют в условиях плана исследования, чтобы увидеть, насколько эффективным было экспериментальное вмешательство. Эффективность лечения оценивается в сравнении с контрольной групой. Может быть более одной экспериментальной группы или более одной контрольной группы.
Испытание может быть слепым, в нём информация, которая может повлиять на участников, скрывается до завершения эксперимента. В слепом испытании информацию могут скрывать от любого участника эксперимента, включая субъектов, исследователей, техников, аналитиков данных и оценщиков. Хорошее скрытие может уменьшить или устранить некоторые источники экспериментальной необъективности.
Случайность при распределении субъектов по группам уменьшает системную ошибку отбора и смещение распределения, балансируя как известные, так и неизвестные перемменые (прогностические) факторы при назначении лечения. Слепое испытание уменьшает другие формы смещения экспериментатора и субъекта.
Термины «РКИ» и «рандомизированное исследование» иногда используются как синонимы, но последний термин упускает упоминание о контроле и поэтому может описывать исследования, в которых сравнивают несколько групп лечения друг с другом в отсутствие контрольной группы.
Содержание
-
1 Классификации
- 1.1 По дизайну исследования
-
2 Рандомизация
-
2.1 Методика проведения
- 2.1.1 Простое рандомизирование
- 2.1.2 Ограниченная рандомизация
- 2.2 Сокрытие распределения
- 2.3 Размеры выборки
-
2.1 Методика проведения
- 3 Слепой метод
- 4 История
- 5 Примечания
Классификации
По дизайну исследования
Одним из способов классификации РКИ является дизайн исследования. От наиболее распространенных в медицинской литературе до самых распространенных категорий, основные категории планов исследования РКИ:
- Параллельная группа — каждый участник случайным образом назначается группе, и все участники группы получают (или не получают) вмешательство.
- Кроссовер — со временем каждый участник получает (или не получает) вмешательство в случайной последовательности.
- Кластер — уже существующие группы участников (например, деревни, школы) выбираются случайным образом для получения (или не получения) вмешательства.
- Факториал — каждый участник случайным образом распределяется по группе, которая получает определенную комбинацию вмешательств или невмешательств (например, группа 1 получает витамин X и витамин Y, группа 2 получает витамин X и плацебо Y, группа 3 получает плацебо X и витамин Y и группа 4 получает плацебо X и плацебо Y).
Анализ 616 РКИ, проиндексированных в PubMed в декабре 2006 года, показал, что 78% были исследованиями в параллельных группах, 16% были перекрестными, 2% были расщепленными, 2% были кластерными и 2% были факториальными.
Эталонным дизайном клинических исследований являются рандомизированные контролируемые двойные слепые исследования, при которых рандомизация осуществляется тайно, а контрольная группа получает плацебо, не отличимое от исследуемого вмешательства.
Рандомизация
Преимущества правильной рандомизации в РКИ включают в себя:
- «Это устраняет предвзятость при назначении лечения», в частности, предвзятость выбора и смешение.
- «Это облегчает ослепление (маскировку) идентичности процедур от исследователей, участников и экспертов».
- «Это позволяет использовать теорию вероятностей, чтобы выразить вероятность того, что любая разница в результатах между группами лечения просто указывает на шанс».
В рандомизации пациентов к различным вмешательствам участвуют два процесса. Первый — это выбор процедуры рандомизации для генерации непредсказуемой последовательности распределений; это может быть простое случайное распределение пациентов в любой из групп с равными вероятностями, может быть «ограниченным» или может быть «адаптивным». Вторым и более практичным вопросом является сокрытие распределения, которое относится к строгим мерам предосторожности, принятым для обеспечения того, чтобы групповое распределение пациентов не было выявлено до окончательного распределения их по соответствующим группам. Неслучайные «систематические» методы группового назначения, такие как чередование субъектов между одной группой и другой, могут вызвать «безграничные возможности загрязнения» и могут привести к нарушению сокрытия распределения.
Однако эмпирические доказательства того, что адекватная рандомизация меняет результаты относительно неадекватной рандомизации, было трудно обнаружить.
Методика проведения
Идеальная процедура рандомизации позволила бы достичь следующих целей:
- Максимизировать статистическую мощность, особенно в анализе подгрупп. Как правило, равные размеры групп максимизируют статистическую мощность, однако, неравные размеры групп могут быть более мощными для некоторых анализов (например, многократное сравнение плацебо по сравнению с несколькими дозами с использованием процедуры Даннетта), и иногда желательны по неаналитическим причинам (например, пациенты могут быть более мотивированы к регистрации, если есть больше шансов получить тестовое лечение, или регулирующие органы могут потребовать минимальное количество пациентов, подвергаемых лечению).
- Минимизировать смещение выбора. Это может произойти, если иследователи могут сознательно или неосознанно отдавать предпочтение пациентам между группами лечения. Хорошая процедура рандомизации будет непредсказуемой, так что иследователи не смогут угадать распределение группы следующего субъекта на основании предыдущих назначений лечения. Риск предвзятости выбора наиболее высок, если известны предыдущие назначения лечения (как в неслепых исследованиях) или можно предположить (возможно, если лекарство имеет характерные побочные эффекты).
- Минимизировать смещение распределения. Это может происходить, когда переменые, которые влияют на результат, не одинаково распределены между группами лечения, и эффект лечения смешивается с эффектом переменых (то есть, «случайным смещением»). Если процедура рандомизации вызывает дисбаланс в переменых, связанных с исходом по группам, оценки эффекта могут быть смещены, если они не скорректированы для переменых (что может быть неизмеренным и, следовательно, его невозможно скорректировать).
Тем не менее, ни одна процедура рандомизации не отвечает этим целям при любых обстоятельствах, поэтому исследователи должны выбрать процедуру для данного исследования, основываясь на его преимуществах и недостатках.
Простое рандомизирование
Это обычно используемая и интуитивно понятная процедура, похожая на «повторное честное подбрасывание монет». Также известная как «полная» или «неограниченная» рандомизация, она устойчива как к отбору, так и к случайным отклонениям. Тем не менее, её основным недостатком является возможность несбалансированных размеров групп в небольших РКИ. Поэтому она рекомендуется только для РКИ с более чем 200 субъектами.
Ограниченная рандомизация
Чтобы сбалансировать размеры групп в более мелких РКИ, рекомендуется некоторая форма «ограниченной» рандомизации. Основные типы ограниченной рандомизации, используемые в РКИ:
- Рандомизация блоков с перестановками или блокировка рандомизации: указываются «размер блока» и «коэффициент распределения» (количество субъектов в одной группе по сравнению с другой группой), и субъекты распределяются случайным образом в каждом блоке. Например, размер блока 6 и коэффициент распределения 2: 1 приведет к случайному распределению 4 субъектов в одну группу и 2 в другую. Этот тип рандомизации может сочетаться с «стратифицированной рандомизацией», например, по центру в многоцентровом испытании, чтобы «обеспечить хороший баланс характеристик участников в каждой группе». Частным случаем рандомизации перестановочных блоков является случайное распределение, при котором вся выборка рассматривается как один блок. Основным недостатком рандомизации перестановочных блоков является то, что даже если размеры блоков велики и случайным образом изменяются, процедура может привести к смещению выбора. Другим недостатком является то, что для «правильного» анализа данных от перестановочно рандомизированных блоков РКИ требуется стратификация по блокам.
- Адаптивные методы рандомизации с предвзятыми монетами (из которых рандомизация урн является наиболее широко известным типом): в этих относительно необычных методах вероятность быть назначенной группе уменьшается, если группа перепредставлена, и увеличивается, если группа недопредставлена. Считается, что эти методы менее подвержены влиянию смещения выбора, чем рандомизация перестановочных блоков.
Сокрытие распределения
Сокрытие распределения (определяемое как «процедура защиты процесса рандомизации таким образом, чтобы назначаемое лечение не было известно до того, как пациент был включен в исследование»), является важным в РКИ. На практике клинические исследователи в РКИ часто испытывают трудности в поддержании беспристрастности. Существует множество историй о том, что следователи держат запечатанные конверты у фонарей или обыскивают офисы, чтобы определить групповые задания, чтобы диктовать назначение их следующему пациенту. Такая практика привносит предвзятость выбора и факторы, которые мешают рандомизации, что может привести к искажению результатов исследования. Надлежащее сокрытие распределения должно побудить пациентов и исследователей к определению распределения лечения после начала исследования и после его завершения. Связанные с лечением побочные эффекты или неблагоприятные события могут быть достаточно конкретными, чтобы выявить распределение среди исследователей или пациентов, тем самым внося систематическую ошибку или влияя на любые субъективные параметры, собранные исследователями или запрошенные у субъектов.
Некоторые стандартные методы обеспечения сокрытия выделяют включение последовательно пронумерованные, непрозрачные, запечатанные конверты; последовательно пронумерованные контейнеры; контролируемая фармацевтикой рандомизация; и центральная рандомизация. Рекомендуется, чтобы методы маскирования распределения были включены в протокол РКИ, и чтобы методы маскирования распределения были подробно представлены в публикации результатов РКИ; однако, исследование 2005 года установило, что у большинства РКИ скрыта маскировка распределения в их протоколах, или в их публикациях или в обоих. С другой стороны, исследование 146 метаанализов, проведенное в 2008 году, пришло к выводу, что результаты РКИ с неадекватным или нечетким сокрытием распределения имели тенденцию быть склонными к положительным эффектам, только если результаты РКИ были субъективными, а не объективными.
Размеры выборки
Количество лечебных груп (субъектов или групп субъектов), назначенных контрольной и лечебной группам, влияет на надежность РКИ. Если эффект от лечения невелик, количество единиц лечения в любой группе может оказаться недостаточным для отклонения нулевой гипотезы в соответствующем статистическом тесте. Неспособность отвергнуть нулевую гипотезу будет означать, что лечение не показывает статистически значимого результата на экспериментальной групе в данном тесте. Но по мере увеличения размера выборки тот же РКИ может продемонстрировать значительный эффект лечения, даже если этот эффект мал.
Слепой метод
РКИ могут быть ослеплены (также называемыми «маскированными») «процедурами, которые не позволяют участникам исследования, лицам, осуществляющим уход, или оценщикам узнать, какое вмешательство было получено». В отличие от сокрытия распределения, ослепление иногда неуместно или невозможно выполнить в РКИ; например, если РКИ включает лечение, в котором необходимо активное участие пациента (например, физиотерапия), от участника не возможно скрыть вмешательство.
Традиционно слепые рандомизированные клинические испытания классифицируются как «одиночные слепые», «двойные слепые» или «тройные слепые»; однако в 2001 и 2006 годах два исследования показали, что эти термины имеют разные значения для разных людей. В Заявлении CONSORT (Consolidated Standards of Reporting Trials) 2010 года указывается, что авторам и редакторам не следует использовать термины «одиночный слепой», «двойной слепой» и «тройной слепой»; вместо этого в отчетах о слепом РКИ следует обсудить «Если это будет сделано, кто был ослеплен после назначения на вмешательства (например, участники, поставщики медицинских услуг, те, кто оценивает результаты) и как.»
История
Рандомизированные контролируемые испытания проводятся с середины XX века. Они являются основой доказательной медицины. При анализе результатов РКИ используются статистические методы, определяющие научную обоснованность получаемых выводов. РКИ наиболее оптимально для оценки эффективности лечения и имеет низкую вероятность возникновения систематической ошибки. Недостатками РКИ являются сложность осуществления и невозможность распространения результатов на некоторые популяции.
Просмотров 3.3к.
Обновлено 25.03.2014
Содержание
- РАНДОМИЗИРОВАННЫЕ КОНТРОЛИРУЕМЫЕ
- КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
РАНДОМИЗИРОВАННЫЕ КОНТРОЛИРУЕМЫЕ
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Что такое РКИ? Рандомизированныеконтролируемые клинические исследования (РКИ) проводятся с серединыпрошлого века. Их гуманистическая направленность стала ответом научногосообщества на проведение экспериментов на людях во время Второй мировойвойны в фашистских концлагерях. РКИ являются фундаментом доказательноймедицины, так как на их основе происходит принятие научно-обоснованныхрешений и проводится мета-анализ. Поэтому целесообразно более подробноостановиться на особенностях их планирования и проведения. РКИпредполагают использование тонких и чувствительных операционных истатистических методов во время проспективного исследования, в которомсопоставляемые группы получают различные виды анализируемыхвмешательств, лица контрольной группы — стандартное по современнымпредставлениям лечение.
Отличительной особенностьюсовременных РКИ является неукоснительное следование этическим нормам.Перед началом любого РКИ его протокол должен быть одобрен национальнымили региональным этическим комитетом (часто и тем, и другим). Вдальнейшем этический комитет в обязательном порядке информируется осерьезных побочных эффектах, возникших в ходе РКИ и всех изменениях впротоколе. До включения в исследование его потенциальный участник долженна добровольной основе подписать информированное согласие, где вдоступной форме должна быть изложена цель исследования, возможныеосложнения или неудобства, преимущества, связанные с участием больного висследовании, и альтернативные методы лечения. Пациент должен бытьпроинформирован о том, что решение о его участии или неучастии в данномклиническом исследовании на любом этапе выполнения никак не отразится надальнейшей тактике его ведения, и он в любой момент может прекратитьсвое участие в РКИ. Только после получения информированного согласияпациент может принимать участие в исследовании. Если РКИ предполагаетпроведение суб-исследований,требующих дополнительного обследования, то на них тоже необходимополучить информированное согласие пациента. В ряде случаев, например припроведении РКИ у детей, информированное согласие подписывают родителиили опекуны.
ЦЕЛИ И ЗАДАЧИ ИССЛЕДОВАНИЯ
Дляоценки новых методов лечения и диагностики могут применяться дваосновных вида исследования — контролируемые и неконтролируемые.Неконтролируемое клиническое испытание (без сравнения с ужеприменяющимся способом терапии или плацебо) новых методов лечениядопустимо только в исключительных случаях, когда новый метод позволяетспасти жизнь или радикально улучшить прогноз у пациентов, страдающихнеизлечимым заболеванием (в настоящее время большинство такихисследований связано с ВИЧ-инфекцией). Необходимо подчеркнуть, что даже вэтом случае предполагаемая польза нового метода должна бытьубедительной и сопоставимой, например, с эффектом инсулина при сахарномдиабете I типа.
Особняком стоят неконтролируемыеклинические испытания при изучении новых лекарственных препаратов наэтапе фазы I и II их клинического исследования, когда на здоровыхдобровольцах и ограниченном числе пациентов определяютсяфармакокинетические и фармакодинамические характеристики нового методалечения.
Актуальность проведения контролируемыхклинических исследований в настоящее время существенно возросла, так какони необходимы не только для доказательной медицины, но и привыполнении рутинной научной работы, в том числе и диссертационныхисследований клинической направленности.
ПланированиеРКИ начинается с формулирования цели и задач исследования, которыеотличаются новизной и практической значимостью. Цель исследования должнаотличаться как научной новизной, так и практической значимостью.Например, именно таким исследованием было SYST-EUR, результаты которого взначительной степени реабилитировали антагонисты кальция в леченииартериальной гипертензии, когда на них обрушилась волна критики порезультатам не совсем корректного мета-анализа.
Поэтому,как правило, крупные многоцентровые РКИ планируют известные в своейобласти специалисты. Каждое новое РКИ оригинально по дизайну и популяциипациентов, участвующих в нем (определяется критериями включения иисключения), поэтому уже существующие протоколы не могут быть полностьювоспроизведены вновь, хотя и могут служить некой базой для адаптации. Вкачестве примера решения сходной задачи можно привести два сильноразличающихся как по дизайну, так по итоговым результатам протоколаисследований ALLHAT и ASCOT. Точная формулировка основной цели имеетрешающее значение. Так, можно в качестве примера привести исследованиеELITE I, в котором сравнивалась эффективность ингибитора АПФ каптоприла иантагониста рецепторов ангиотензина II лозартана у пациентов схронической сердечной недостаточностью. Достоверных различий между этимидвумя режимами терапии не выявлено, но цель исследования была «доказатьпреимущества лозартана», и она не была достигнута. Однако новый класспрепаратов, оказавшийся не хуже эталонных ингибиторов АПФ, стал важнымсобытием для кардиологов. Если бы целью исследования было доказательстворавнозначной эффективности лозартана и каптоприла при хроническойсердечной недостаточности, никакой последующей полемики попросту невозникло.
Задачи, решаемые в РКИ, не должны бытьмногочисленными, поскольку это может привести к ложноположительнымрезультатам и затруднить интерпретацию полученных данных для практики.
КОНЕЧНЫЕ ТОЧКИ
Существуют«жесткие» и «мягкие» (суррогатные) конечные точки, оцениваемые в РКИ. Кжестким конечным точкам относят, например, общую и сердечно-сосудистуюсмертность, инсульт, инфаркт миокарда. Примерами суррогатных конечныхточек являются гипертрофия левого желудочка, фракция выброса, уровеньлипидов, глюкозы крови т.д. R.J. Temple определяет суррогатные конечныеточки как «…косвенный критерий оценки в клиническом испытании -лабораторный показатель или симптом, который заменяет клиническизначимый исход, прямо характеризующий самочувствие больного, егофункциональное состояние и выживание. Изменения косвенного
критерияоценки, вызываемые лечением, должны отражать изменения клиническизначимого критерия (исхода)». Необходимость использования суррогатныхконечных точек обусловлена тем, что для получения статистическидостоверного влияния вмешательства на жесткие точки необходимообследовать большое число пациентов и наблюдать их на протяжениидлительного времени. Суррогатные конечные точки (типичные для каждойнозологии) позволяют существенно уменьшить длительность исследования иколичество больных, участвующих в нем. Однако обязательно нужно помнить:выбранные суррогатные точки должны иметь доказанное влияние на прогнозисследуемого заболевания. Безусловно, выбранным конечным точкамнеобходимо иметь не только научное, но и клиническое значение.Предпочтение отдается объективным (например, развитие инсульта,подтвержденное компьютерной томографией), стандартизованным критериям(индекс массы миокарда левого желудочка по данным эхокардиографии) идискретным показателям эффективности (показатели типа да/нет, жив/умер,госпитализация/отсутствие госпитализации, улучшение/ухудшение), покоторым рассчитывается абсолютный и относительный эффект вмешательства иих легко интерпретировать практическому врачу.
Вмногих РКИ выделяют основные конечные точки, по которым оцениваетсяэффективность вмешательства, и второстепенные конечные точки,учитывающие другие аспекты этого вмешательства (например, побочныеэффекты, качество жизни, когнитивные нарушения, лабораторные показатели ит.д.). Хотя в ряде случаев последние сами могут становиться основнойконечной точкой (например, когнитивные изменения в исследовании SCOPE,холестерин — в исследованиях по атеросклерозу, уровень креатинина — висследованиях по почечной недостаточности, артериальной гипертензии исахарному диабету).
Впоследнее время в РКИ стали широко использоваться так называемыекомбинированные конечные точки, объединяющие сразу несколькопоказателей. Например, в исследовании PREAMI конечной точкой являлсяпоказатель смерть + госпитализация с сердечной недостаточностью +сердечное ремоделирование. Как видно, здесь использованы как жесткие,так и суррогатные конечные точки.
Существеннооблегчить задачу по выбору оптимальных конечных точек при планированииисследований может использование существующих баз данных о клиническихисходах (табл. 7.1).
Таблица 7.1. Источники информации рекомендуемых для оценки клинических показателях при проведении исследований
Ещеодной особенностью современных РКИ является проведение суб-исследований(суб-протоколов) в рамках основного РКИ, которые используютдополнительные методы обследования и позволяют ответить надополнительные вопросы, остававшиеся за рамками основного РКИ.
Длительность исследования (интервал времени от момента рандомизации больного и осуществления вмешательства до момента
оценкиконечного исхода заболевания) определяется целью и задачамиисследования, зависит от характера патологии, особенностей естественноготечения заболевания, риска развития исследуемых осложнений и времени,необходимого вмешательству для оказания потенциального влияния навыбранные конечные точки.
ВЫБОР БОЛЬНЫХ
Вторымпо значимости разделом РКИ (после формулирования цели и задачисследования) является определение критериев включения и исключения изисследования. Критерии включения предопределяются целью исследования,более широкие из них облегчают набор пациентов и позволяютэкстраполировать полученные результаты на большую популяцию больных.Однако в этом случае существует опасность формирования разнородныхисследуемых групп больных как по исходным клинико-демографическимпоказателям, так и по эффективности тестируемого вмешательства. Обычно вРКИ включают пациентов со средней тяжестью заболевания, хотя упациентов с исходно более высоким риском осложнений можно в болеекороткие сроки оценить эффект вмешательства на жесткие конечные точки.Группа пациентов с низким риском и легким течением заболевания требуетдлительного наблюдения и потенциально опасна в получении статистическидостоверного эффекта вмешательства, тогда как на самом деле оно можетоказаться эффективным.
Критерииисключения должны минимизировать возможность ошибок при проведенииисследования (например, исключение из исследования больных стерминальной стадией заболевания, сниженной функцией печени и почек).Если данный контингент пациентов не является предметом РКИ, в негообычно не включают несовершеннолетних, женщин в период беременности илактации или не использующих контрацепцию, онкологических и психическихбольных. Важной задачей критериев исключения является обеспечениеодинакового лечения и ведение пациентов в исследуемой и контрольнойгруппах, а также исключение применения в них во время исследованияпрепаратов, сходных с испытуемым.
В целом чем крупнееРКИ и чем быстрее его планируют закончить, шире должны быть критериивключения и тем меньше критериев исключения.
РАЗМЕР ИССЛЕДОВАНИЯ
Никакихнормативов, кроме получения необходимой статистической достоверностипри определении числа пациентов, участвующих в исследовании, несуществует. Небольшое количество пациентов не позволяет добитьсяоднородности сравниваемых групп и статистически достоверного эффектавмешательства. Размер РКИ зависит от ожидаемого клинически значимогоэффекта вмешательства.
Типичным исходным показателем,необходимым для расчета размера РКИ, является ожидаемый исходзаболевания при стандартном общепринятом лечении на момент планированияисследования. Кроме этого, весьма полезными оказываются данныезакончившихся РКИ по аналогичной тематике.
Принятосчитать, что снижение относительного риска исхода заболевания на 20%является клинически значимым. При этом степень достоверности полученияложноположительного обычно устанавливается на уровне 0,05 («а» или «Iтип ошибки»). В свою очередь степень достоверности ложноотрицательногорезультата обычно устанавливается на уровне 0,1 («b» или «II типошибки»).
РазмерРКИ, в котором в качестве критериев эффективности вмешательстваиспользуются дискретные показатели исхода заболевания, всегда больше,чем размер такого же РКИ, но в котором критерием эффективностивмешательства являются продолженные показатели исхода заболевания(средние величины показателя или функционального исхода).
Достаточностьгрупп наблюдения зависит от степени предполагаемых различий в эффектевмешательства в опытной и контрольной группах, видом статистическогопоказателя эффекта вмешательства (частоты, средние величины).Естественно, чем больше ожидаемое различие в эффекте между ними, темменьше окажется необходимое число наблюдений.
Приодинаковой степени точности необходимое число наблюдений будетзначительно меньше, когда для оценки эффекта вмешательства используютсясредние величины, а не частотные показатели.
Припроведении исследования очень важно получить достоверную информацию обэффективности вмешательства в возможно более сжатые сроки. Для этогоиспользуют многоцентровые РКИ. В них происходит кооперирование (частомеждународное) и стандартизация исследовательских центров по единойпрограмме и методам наблюдения, что позволяет получить сопоставимыеданные разных учреждений.
РАНДОМИЗАЦИЯ
Надежностьданных РКИ прямо зависит от сопоставимости сравниваемых групп.Категорически нельзя сравнивать группы, в одну из которых были включеныпациенты с анализируемым вмешательством, а в другую — отказавшиеся отучастия в РКИ и получавшие «традиционную» терапию. Также нельзясопоставлять результаты нового метода лечения в разных клиниках, еслиони не проводили его оценку по одному общему протоколу (различий втехнической оснащенности, квалификации кадров и принятых стандартахлечения). Аналогичные недостатки имеет и метод «исторического контроля».
Одноиз обязательных условий надежности исследования — сопоставимостьсравниваемых групп. Очень часто в публикуемых исследованиях нарушаетсяэтот важнейший принцип. Например, группы несопоставимы, если в одну изних включаются больные, леченные новым методом, а в другую -отказавшиеся от него. Согласие больного подвергнуться лечению новымметодом зависит от типа нервной деятельности, степени выраженностизаболевания, общего состояния, возраста и прочих факторов, которые могутиметь прогностическое значение. Иногда сопоставляются результаты новогометода лечения, проводимого в одной клинике, с эффективностьюстандартного способа лечения, используемого в других лечебныхучреждениях. В этом случае неоднородность групп еще больше увеличиваетсяза счет различий в технической оснащенности и квалификации кадров,использования разных вспомогательных лечебных методов и прочего.Примерно такими же недостатками характеризуется метод так называемого«исторического контроля», когда сопоставляются результаты лечения довнедрения нового метода с эффективностью современного лечения, т.е.сравнивают специально подобранную для применения нового метода лечениягруппу больных с неподобранной группой «прошлого». К рандомизации такжене относятся методы, при которых больных распределяют в опытную иконтрольную группы в порядке поступления, по начальным буквам имен ифамилий, по нечетным и четным дням включения в исследование, дате днярождения. При таком отборе врач может предвзято включить пациента схорошим, по его мнению, эффектом от вмешательства в «правильную» группу инаоборот.
Рандомизация является ключевым моментом при проведении РКИ. Она должна обеспечить случайное распределение больных, независящее от желания врача или каких-либо других факторов, исопоставимость сравниваемых групп по клинико-демографическимхарактеристикам пациентов, тяжести основного исследуемого заболевания,сопутствующей патологии и проводимой терапии.
Принебольшом числе пациентов в группах даже правильно проведеннаярандомизация не может обеспечить их однородность. В этом случаеиспользуется предварительная стратификация (stratum — слой,пласт), при которой распределение вариантов вмешательства происходит вболее однородных группах больных, изначально сформированных по одномуили нескольким важным признакам. Различия пациентов по этим ключевымпризнакам должны быть минимальными. Такой подход практически гарантируетполучение надежных результатов и отсутствие систематической ошибки.Отсутствие систематической ошибки в РКИ называют обоснованностью(validity).
Наиболее частой причиной несопоставимостисравниваемых групп после рандомизации может быть включение в анализ невсех участвовавших в исследовании пациентов.
Существуетбольшое количество методов рандомизации: метод непрозрачныхзапечатанных и последовательно пронумерованных конвертов, компьютерныйметод (процедура рандомизации на основе метода генерации случайных чиселпроводится специалистом, непосредственно не участвующим в лечении),метод пронумерованных идентичных контейнеров, подготовленныхфармацевтической фирмой (код и истинное содержание контейнеров неизвестны ни пациентам, ни врачам, участвующим в исследовании),централизованная рандомизация по телефону (IVRS) специалистомфармацевтической фирмы. Наиболее объективным считается последний из них,а наименее объективным — метод конвертов.
Прирандомизации необходимо соблюсти одно важное условие — непредсказуемыйхарактер распределения больных на группы (нельзя предугадать, в группувмешательства или контроля попадет пациент). Ни пациент, ниисследователь не должны знать, в какие группы попадают пациенты. Этодостигается при использовании «слепого», «двойного слепого» и даже«тройного слепого» отбора. Если о назначаемом вмешательстве известнотолько врачу, такая организация РКИ называется «простым слепымиспытанием» (single-blind trial). Если все лица исследовательскогоцентра, общающиесяи работающие с пациентами, не знают, кто из них какое лечение получает,то это «двойное слепое испытание» (double-blind trial). Подобнаяорганизация РКИ абсолютно необходима в тех случаях, когда велика рольсопутствующего лечения, например при антибиотико- и химиотерапии.
Частопроцесс «ослепления» достаточно сложен, например традиционная терапияпредполагает применение таблетированных форм, а новое вмешательствоиспользует инъекции. В этом случае в первой группе лечение придетсядополнить введением физиологического раствора, а во втором — приемомплацебо per os. Нелишне отметить, что вид, органолептические свойства и кратность назначения сравниваемых препаратов должны быть одинаковыми.
В настоящее время существует несколько причин, по которым в научных исследованиях рандомизация не используется:
• незнание врачами-исследователями основ доказательной медицины;
• слепое следование традиционной практике и боязнь получить результаты, отличные от общепринятых и мнения авторитетов;
• боязнь применить у пациента менее эффективный метод вмешательства, ноименно ради выявления его реальной эффективности проводится РКИ;
• существующее негативное общественное мнение, отождествляющее РКИ с испытаниями на людях.
Втоже время в последние годы термин «рандомизация» стал использоватьсяавторами публикаций как «магическое заклинание», гарантирующее авторамотсутствие критики и повышающее их научный рейтинг самооценки. Истиннаярандомизация подменяется ее декларированием, проявляетсянесопоставимостью сравниваемых групп и «информационным шумом» от выводовпо некачественно сделанным исследованиям. Так, K.F. Schultz et al.считают, что только 9-15% статей в медицинских журналах имели истиннуюрандомизацию.
ДИЗАЙН ИССЛЕДОВАНИЙ
Сегоднядля решения конкретного клинического вопроса идентифицированыоптимальные типы (табл. 7.2) и дизайны (рис. 7.1) исследований. Каждыйиз видов исследований имеет свои достоинства и недостатки (табл. 7.4).
Таблица 7.2. Клинические вопросы и оптимальные типы исследований для их решения
Важнопонять, что структура исследования, в существенной мерепредопределяемая поставленным клиническим вопросом, прямо влияет настепень доказательности полученных данных (табл. 7.3).
Рис. 7.1. Наиболее часто используемые дизайны проведения клинических исследований
Таблица 7.3. Уровень доказательности исследований в зависимости от их структуры при оценке эффективности вмешательства
Таблица 7.4. Достоинства и недостатки исследований с различной структурой
АНАЛИЗ И ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ
Главной задачей статистического анализа РКИ является установление разницы и степени ее достоверности по исходам (конечным
точкам)между группой с анализируемым вмешательством и контрольной группой. Внастоящее время существует много пакетов статических программ дляанализа полученных результатов (BMDP, SOLO, Statistica и другие). Дляполучения объективной информации об эффективности вмешательства в анализнеобходимо включать всех первоначально рандомизированных больных(intention-to-treat analysis), а не только тех, которым лечениепроведено в строгом соответствии с протоколом исследования (on protocolanalysis). Это один из основных способов минимизировать возможныеошибки, когда при intention-to-treat analysis исходят из допущения, чтовсе пациенты получили лечение, предписанное при рандомизации.
Выбываниепациентов из исследования по разным причинам (отказ от дальнейшегоучастия, побочные эффекты и плохая переносимость лечения, нарушенияпротокола пациентами или исследователями) не должно превышать 15% отисходного числа рандомизированных больных. Если процент выше, результатыисследования некорректны. Такой подход существенно снижает вероятностьполучения ложноположительного результата, когда на самом деле онотсутствует. Считается: если более 80% из включенных больных наблюдалисьдо конца исследования, его результаты могут быть достаточно надежными.
Длястатистического анализа большого массива дискретных конечных точеквычисляют c-квадрат. При малой выборке (число пациентов менее 30 вкаждой из групп вмешательства) используют методы непараметрическойстатистики (тесты Фишера или Йетса).
Результатыисследования представляются с использованием следующих показателей:число больных, которых необходимо пролечить для того, чтобыпредотвратить один нежелательный исход заболевания,абсолютного/относительного риска нежелательного исхода и их снижения суказанием статистической достоверности.
ПУБЛИКАЦИЯ РЕЗУЛЬТАТОВ
Частостатью с итогами РКИ предваряет опубликование его наиболее значимыхрезультатов и выводов в материалах крупных международных конференций исъездов. Структура статьи имеет обычный характер. Обязательнымтребованием является максимально широкое представление дизайна истатистических аспектов РКИ. Особый интерес может представлятьобсуждение результатов, так как они
могут дать дополнительную информацию о спорных моментах при его проведении.
Внастоящее время для проведения РКИ разработаны этические иметодологические стандарты. Необходимо помнить о том, чтоплацебо-контролируемые исследования оправданы, когда не существуетальтернативного способа лечения, эффективность которого не вызываетсомнений.
Сегодня врачам, исследователям иорганизаторам исследований необходимо непрерывно повышать не толькопрофессионализм, но и уровень знаний в области доказательной медицины,правоведения и GCP. При этом само проведение РКИ — не только наука, но иособый (и достаточно прибыльный) медицинский бизнес, что предъявляетеще более высокие этические требования ко всем его участникам.
Литература
1. Pocock S.J. Clinical trials. A practical approach. — John Wiley & Sons
Ltd., 1983.
2. Guyatt G.H. etal. Users’ guides to the medical literature. II. How to use an articleabout therapy or prevention. A. Are the results of the study valid //JAMA. — 1993. — Vol. 270. — Р. 2598-2601.
3. Guyatt G.H. etal. Users’ guides to the medical literature. II. How to use an articleabout therapy or prevention. B. What were the results and will they helpme in caring for my patients // JAMA. — 1994. — Vol. 271. — P. 59-63.
4. Begg C. et al. Improving the quality of reporting of randomized controlled trials. The CONSORT statement // JAMA. — 1996. — Vol. 276 —
P. 637-639.
5. Jadad A. Randomized Controlled Trials. A Users Guide BMJ Publishing Group. — London, 1998
Источник
ЛЕЧЕНИЕ И РИСК: ПРИЧИНЫ НЕДОСТОВЕРНОСТИ РЕЗУЛЬТАТОВ — СИСТЕМАТИЧЕСКИЕ И СЛУЧАЙНЫЕ ОШИБКИ
План Случайная ошибка Систематическая ошибка Оценка влияния систематической и случайной ошибки Методы снижения вероятности возникновения систематической ошибки в исследованиях, посвященных эффективности лечения и риску
Случайная ошибка В любом эксперименте возможна случайная ошибка. По аналогии с подбрасыванием монеты: даже у идеально сбалансированной монеты орел и решка не всегда выпадают одинаково часто, т. е. результат зависит от случая (орел может выпадать 8, реже — 9 и совсем редко — 10 из 10 раз. ). Т. е. результаты будут различаться в связи с влиянием случайных факторов.
Пример Данные, полученные в рандомизированном контролируемом испытании (РКИ), свидетельствуют о том, что в группе лечения умирают 10 из 100, а в группе контроля — 20 из 100 больных. Значит ли это, что проводимая терапия действительно снижает уровень смертности на 50%?
Возможно, но нельзя быть в этом уверенным, так как достоверно неизвестно, насколько эффективно лечение (если оно вообще эффективно). «Почему никогда нельзя быть абсолютно уверенными в размере эффекта лечения, независимо от статистической мощности исследования и того, насколько хорошо оно было спланировано? » Потому что всегда возможна случайная ошибка.
Систематическая ошибка Что имеют в виду, когда говорят о достоверности или обоснованности результатов исследования? Под достоверностью подразумевается степень, в которой результат исследования позволяет правильно ответить на поставленный вопрос или измерить тот или иной показатель. Достоверность используется в качестве технического термина, с помощью которого описывают вероятность возникновения систематической ошибки.
В отличие от случайной систематическая ошибка приводит к появлению систематического отклонения от истинного значения в определенную сторону. В исследованиях, посвященных оценке эффективности и безопасности лечения, наличие систематической ошибки сопровождается недооценкой или переоценкой его преимуществ или недостатков.
Различия между группами лечения и контроля, влияющие на прогноз Систематическая ошибка может быть обусловлена тем, что группы лечения и контроля изначально различались по факторам, влияющим на клинический исход (прогноз): пол, возраст, наличие сопутствующих заболеваний, тяжесть заболевания и т. д.
Например, риск развития инсульта будет выше у больных пожилого возраста, мужчин, при наличии выраженных патологических изменений сосудов (атеросклероз) и артериальной гипертонии. Каждая из перечисленных характеристик называется прогностическим фактором, или фактором, определяющим клинический исход.
Если в группе лечения атеросклероз более выраженный, или возраст участников старше, в ней будет выше частота развития неблагоприятных клинических исходов, чем в группе контроля. В данном случае возникнет систематическая ошибка, приводящая к занижению эффективность лечения, а полученные результаты будут неистинными (недостоверными).
Если в контрольную группу будет включено больше мужчин или больных с более высокими средними показателями артериального давления, чем в группу вмешательства, возникнет систематическая ошибка, ведущая к переоценке эффективности лечения.
Эффект плацебо Даже в том случае, когда факторы риска в основной и контрольной группах не различаются, эффективность вмешательства может быть оценена неверно. Так, больные, уверенные в получении активного лечения, могут ожидать наступления улучшения, и само это ожидание приведет к положительным переменам в их самочувствии и даже функциональном статусе. Таким образом, эффект плацебо может приводить к завышению реальной эффективности лечения.
Дифференцированный подход к проведению вмешательств (дополнительные методы лечения, влияющие на частоту развития оцениваемого клинического исхода) Другой причиной появления систематической ошибки может стать дифференцированный подход (дополнительные вмешательства, отличные от тех, которые изучаются в данном исследовании) в группах лечения и контроля. Например, если проведении испытания нового препарата, снижающего риск развития инсульта, в основную группу будет включено больше больных, которые получают аспирин или клопидогрел, чем в группу контроля, оценка эффективности изучаемого лечения будет завышена, поскольку прием аспирина и клопидогрела снижает риск развития инсульта. Однако, если в основной группе большая доля больных будет применять изотонический раствор натрия хлорида в виде глазных капель или антацидные препараты, то это никак не отразится на вероятности появления систематической ошибки.
Таким образом, результаты исследования могут быть смещены под влиянием систематической ошибки, если в группах сравнения различаются исходные характеристики больных или сопутствующие вмешательства, влияющие на прогноз (т. е. присутствует искажающий фактор). Во избежание систематической ошибки группы должны быть сходными (сравнимыми) до начала исследования и оставаться таковыми на всем его протяжении.
Дифференцированный подход к оценке изучаемого клинического исхода Причиной систематической ошибки также может стать дифференцированный подход к определению изучаемого клинического исхода. Например, решение о том, перенес ли больной преходящее нарушение мозгового кровообращения или микроинсульт, может быть принято в результате совместного обсуждения. Если же в группе контроля данный клинический исход расценивается как инсульт, а в группе лечения — как преходящее нарушение мозгового кровообращения, эффективность терапии будет переоценена.
Выбывание участников из исследования Систематическая ошибка может появляться в тех случаях, когда из исследования выбывает большое число больных. Если частота оцениваемого неблагоприятного клинического исхода у выбывших больных и остальных участников неодинакова, полученные результаты могут оказаться ошибочными.
Оценка влияния систематической и случайной ошибки При изучении принципов доказательной медицины можно столкнуться с непониманием концепций и путаницей в терминологии. На вопрос, что делает результаты исследования достоверными, студенты часто отвечают: «Большие размеры выборки». Однако маленькая выборка не способствует появлению систематической ошибки (и потому не снижает достоверность полученных данных), но повышает риск возникновения случайной ошибки.
Можно снизить влияние случайной ошибки и повысить достоверность результатов отдельных РКИ, обобщив их результаты, т. е. провести мета-анализ.
Методы снижения вероятности возникновения систематической ошибки в исследованиях, посвященных эффективности лечения и риску Т. о. , систематические ошибки возникают вследствие того, что группы лечения и контроля исходно различаются по тем или иным прогностическим факторам либо данные различия появляются в ходе исследования. Каким образом можно уменьшить вероятность возникновения систематической ошибки?
Методы снижения вероятности возникновения систематической ошибки в исследованиях, посвященных оценке эффективности лечения и риска Причина систематической ошибки Методы снижения вероятности возникновения систематической ошибки в исследованиях, посвященных эффективности лечения Методы снижения вероятности возникновения систематической ошибки в исследованиях, посвященных вредным воздействиям или побочным эффектам Рандомизация Коррекция с учетом различий по прогностическим факторам при статистической обработке данных Исходные различия Различие прогностических факторов в основной и контрольной группах
Причина систематической ошибки Методы снижения вероятности возникновения систематической ошибки в исследованиях, посвященных эффективности лечения Методы снижения вероятности возникновения систематической ошибки в исследованиях, посвященных вредным воздействиям или побочным эффектам Различия, возникающие в процессе исследования Эффект плацебо Применение слепого метода в отношении больных Выбор оцениваемых клинических исходов, в меньшей степени подверженных влиянию эффекта плацебо (например, смерть) Сопутствующее вмешательство Применение слепого метода в отношении врачей Регистрация различий в проводимой терапии и внесение соответствующих поправок при проведении статистического анализа
Причина систематической ошибки Методы снижения вероятности возникновения систематической ошибки в исследованиях, посвященных эффективности лечения Различия, возникающие в процессе исследования Систематическая Применение слепого метода в ошибка вследствие отношении дифференцированного исследователей, подхода к оценке оценивающих клинические клинических исходов исходы Выбывание больных из исследования Наблюдение всех больных до конца исследования Методы снижения вероятности возникновения систематической ошибки в исследованиях, посвященных вредным воздействиям или побочным эффектам Выбор оцениваемых клинических исходов, в меньшей степени зависящих от мнения исследователей (например, смерть) Наблюдение всех больных до конца исследования
В исследованиях эффективности новых методов лечения часто удается с успехом применять перечисленные методы. При этом можно снизить вероятность включения в группы вмешательства и плацебо больных с различным влиянием прогностических факторов с помощью рандомизации. Эффект плацебо уменьшается, если внешний вид активного препарата и плацебо будет одинаковым. Использование слепого метода по отношению к врачам, назначающим активное лечение или его имитацию, способно устранить возможность избирательного применения сопутствующих вмешательств, а по отношению к исследователям, оценивающим клинические исходы — значительно уменьшить вероятность возникновения систематической ошибки вследствие дифференцированного подхода к оценке клинических исходов.
Как правило, в исследованиях, посвященных вредным воздействиям или осложнениям лечения, методы для снижения вероятности возникновения систематической ошибки реже достигают своей цели, чем при оценке эффективности вмешательств. Исследователям приходится сравнивать данные о больных, подвергнутых изучаемому воздействию или вмешательству по их собственному выбору либо под действием обстоятельств. При этом повлиять на возможные различия по клиническим исходам можно только путем внесения при статистическом анализе соответствующих поправок на разное влияние прогностических факторов, ипользование слепого метода невозможно, и чтобы снизить влияние эффекта плацебо и вероятность появления систематической ошибки, связанной с различным определением клинических исходов, необходимо выбирать те из них (например, смерть), которые менее подвержены влиянию указанных факторов.
Описанные выше правила применимы не всегда. В некоторых случаях исследователи находят затруднительным, а то и невозможным, рандомизированно включать больных в группы лечения и контроля, предпочитая проводить обсервационные исследования. Независимо от того, рассматриваются вопросы эффективности или безопасности вмешательств, достоверность результатов РКИ почти всегда выше достоверности обсервационных исследований.
Для самостоятельной работы. В результате применения препаратов, содержащих витамин Е, снижается ли смертность от ишемической болезни сердца? 1. Knekt P. , Reunanen A. , Jarvinen R. , Seppanen R. , Heliovaara M. , Aromaa A. Antioxidant vitamin intake and coronary mortality in a longitudinal population study. Am J Epidemiol 1994; 139. 1180— 1189. 2. Yusuf. S. , Dagenais G. , Pogue. J. , Bosch J. , Sleight P. Vitamin E supplementation and cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000; 342: 154 -160.
Для самостоятельной работы. Проведение заместительной гормональной терапии в постменопаузе снижает риск смерти от ИБС? 3. Stampfer M. J. , Colditi G. A. Estrogen replacement therapy and coronary heart disease: a quantitative assessment of the epidemiologic evidence. Prev Med 1991 ; 20: 47— 63. 4. Hulley S. , Grady D. , Bush Т. , et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement (HERS) Research Group. JAMA 1998; 280: 605— 613.